


 النبات
النبات
 الحيوان
الحيوان
 الأحياء المجهرية
الأحياء المجهرية
 علم الأمراض
علم الأمراض
 التقانة الإحيائية
التقانة الإحيائية
 التقنية الحيوية المكروبية
التقنية الحيوية المكروبية
 التقنية الحياتية النانوية
التقنية الحياتية النانوية
 علم الأجنة
علم الأجنة
 الأحياء الجزيئي
الأحياء الجزيئي
 علم وظائف الأعضاء
علم وظائف الأعضاء
 الغدد
الغدد
 المضادات الحيوية
المضادات الحيوية|
أقرأ أيضاً
التاريخ: 26-1-2016
التاريخ: 26-1-2016
التاريخ: 22-1-2016
التاريخ: 24-1-2016
|
الاجهادات في خلايا حقيقيات النواة الراقية
معظم دراسات الاجهادات التي تجري في أحياء اخرى تستهدف فهم تصرف الخلايا تحت ظروف مختلفة لمقارنتها مع الاجهادات في الاحياء المجهرية بغية الوصول الى أهداف يمكن استعمالها في اكتشاف الادوية ومعالجة الامراض الناتجة عن الاجهادات.
خلايا اللبائن تقع ضمن انسجة وأعضاء لذلك يتوقع ان تكون الخلايا من النوع ذات التحمل الضيق Steno. وفيها يكون مسار Mitogen-activated protein kinases(MAPK) اللاعب الرئيس في نقل الاشارات المستلمة عند سطوح الخلايا ويعد مساره من المسارات الثابتة ويتكون من ثلاث مكونات رئيسة وهي MAPK ويعرف أيضاً بـ (ERK) Extracellular signal – regulated kinase والمكون الثاني MAPKK ويعرف (MEK) ERK – activating kinase و MAPKKK ويعرف بـ MEK kinase وهي تعمل بشكل متسلسل كما موضح في الشكل (1).
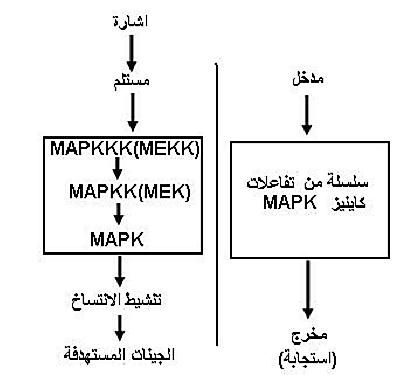
شكل 1 : انظمة الاستجابة للاجهادات في خلايا اللبائن
ويتم استلام الاشارات بواسطة المستلمات مثل G – protein receptor و His – Asp phosphrylay و Receptor –tyrosinekinase او بواسطة البروتينات الاساسية في الأغشية الخلوية، وهذه المستلمات تختلف باختلاف الاحياء. وسلسلة تفاعلات MAPK تؤدي في النهاية الى فسفرة عوامل انتساخ معينة مما يزيد من ألفتها للارتباط بالجينات المستهدفة. والفسفرة تؤدي أيضاً الى امكانية تغير الموقع مثل الانتقال من السايتوبلازم الى النواة، والنتيجة النهائية زيادة انتساخ الجينات المطلوبة وزيادة نواتجها. وعمليات التنشيط بسلسلة تفاعلات MAPK بالفسفرة يمكن ان توهن وتقلل الاشارات بواسطة الفوسفيتيزات مثل Tyrosine phosphatase بعد الوصول الى الاستجابة المطلوبة.
استجابة خلايا اللبائن للإجهاد الحراري
تستجيب مزارع خلايا الإنسان واللبائن الاخرى للحرارة غيرها من الاجهادات وتقوم بتخليق مجموعة من البروتينات كما هو الحال في الخلايا حقيقية النواة والاخرى مثل الاستجابة في خلايا ذبابة الفاكهة Drosophila ، اذ تنشط مجموعة من الجينات وتعطل اخرى، اي يحصل تغيير في نمط تخليق البروتينات وهذا يعكس نمط اختلاف الانتساخ، اذ تبدأ الخلايا بانتساخ الجينات المسئولة عن تخليق بروتينات الصدمة الحرارية وترجمة جزيئات mRNA الخاصة بها. واهم هذه البروتينات في حقيقيات النواة Hsp70 تقريبا ثابت في كل الاحياء وهذا الاستنتاج جاء من دراسة بعض صفاته
• حجمه ثابت تقريباً.
• له نقطة تعادل كهربائي (Ip) Isoelectric point متشابهة.
• له نمط متشابه من البيبتيدات عند هضمه بالتربسين.
• الأجسام المضادة المنتجة ضد Hsp70 في الأفراخ لها تفاعلات متداخلة او متقاطعة مع البروتينات المأخوذة من الخمائر والفئران والانسان والرميح Xenopus وذبابة الفاكهة.
وفي ذبابة الفاكهة تكون عائلة جينات Hsp70 مكونة من بروتينين من بروتينات الصدمة الحرارية Hsp70 و Hsp68 وبروتينات اخرى مرافقة، والمرافقة لا تستحث كلها بالحرارة وانما ينتج بعضها بحرارة ليست مرتفعة بالنسبة لدرجة الحرارة التي تعيش بها الذبابة.
وتختلف الاحياء في عدد نسخ الجينات المسئولة عن تخليق بروتينات الصدمة الحرارية فمثلا في خميرة الخبز تحوي على نسختين في حين تحوي ذبابة الفاكهة على 5 نسخ اضافة الى احتوائها على تواليات تنظيم تقع Upstream بالنسبة للجينات الخاصة بـ Hsp70 وفي الإنسان تكون نسخ Hsp70 مضاعفة ولا تحوي على مناطق اعتراضية Introns ويشاركه في هذه الصفة جينات الهستونات والجين المسئول عن تخليق INF – α ، وهذه حالة غير اعتيادية في جينات حقيقيات النواة والحالة موجودة أيضاً في جينات Hsp70 و Hsp68 في ذبابة الفاكهة، وربما كان ذلك ان جينات حقيقيات النواة تحتاج الى وقت لظهور نواتجها فيما اذا كانت حاوية على الانترونات.
وفي الإنسان فان الجينات hsp70 تحاط بتواليات متكررة Repetitive sequences والتي تمثل مناطق ساخنة لعمليات التأشب وحدوث إدلاف للاكسونات Exon shuffling وكذلك حدوث عمليات اعادة ترتيب للجينات.
وعلى العموم عند تعرض خلايا الانسان المزروعة للحرارة او الاصابة بالفيروسات مثل الفيروسات الغدية Adenoviruses يمكن ان يؤدي الى انتاج بروتينات من عائلة Hsp70 ، والبروتين المنتج يكون بوزن جزيئي Hsp72 وتنتج الخلايا بروتينات اخرى قليلة الوزن الجزيئي Hsp27 اضافة الى تنشيط كاينيزات البروتين التي تساعد في نقل الاشارات، وكذلك يتم تنشيط Akt وفسفرة Hsp27 وكذلك تنشيط كاينيزات الاجهاد مثل c-jun NH2-terminal kinase . وعند عدم امكانية مواجهة الخلايا للاجهادات الحرارية يمكن ان تحفز مسار الاستماتة وكذلك مسار موت الخلايا غير طريق الاستماتة Non-apoptotic cell death .
وتحفز الحرارة عددا من الكاينيزات التنظيمية التي تساهم في تخليق وتنظيم الوصيفات الجزيئية وهذه يمكن ان تساعد في تحوير مسار الاستماتة وتحاول الابقاء على الخلايا حية. وعليه فان معاملة الخلايا بالحرارة يمكن ان يؤدي الى بقاء بعض الخلايا ويسهل بدء عملية الموت للأخرى والمحصلة من ذلك ان الخلايا التي تبقى حية تكون قد حصلت على صفة تحمل الحرارة اضافة الى تحمل اجهادات اخرى.
واول المسارات التي تساعد في بقاء الخلايا حية بعد الصدمة الحرارية هو مسار الاستجابة للصدمة الحرارية والتي تؤدي الى حث Hsp90 , Hsp40 ,Hsp72 , Hsp 27 وتكون تحت سيطرة عوامل انتساخ الصدمة الحرارية HSFs . وبروتينات الصدمة الحرارية عند تكونها تساعد الخلايا لمقاومة اجهادات اخرى مثل الكحول الاثيلي، المعادن الثقيلة، والاجهاد التأكسدي والاسكيمية وتأثير عامل النخر TNF.
وبما ان التعرض للحرارة يؤدي الى مسخ البروتينات وتجمعها، لذلك استهدفت الدراسات المبكرة البحث عن البروتينات الحساسة للحرارة والمهمة والتي تؤدي الى موت الخلايا، وأسفرت الدراسات الى ان مثل هذه البروتينات هي بروتينات الارضية في النواة Nuclear matrix proteins وبروتينات الهيكل الخلوي. وتقوم بروتينات الصدمة الحرارية بإعادة طوي البروتينات النووية قليل في الخلايا المتحملة للحرارة والحاوية على بروتينات الصدمة الحرارية، اذ تظهر هذه الخلايا القابلية على اعادة اذابة البروتينات المتجمعة بعد تعريض الخلايا للحرارة اثناء مدة الشفاء وان وجود Hsp72 يكون كافيا لتقليل تجمع البروتينات النووية ويسرع العمل من اعادة طوي البروتينات بعد الصدمة الحرارية، وتساعد في ذلك بعض العوامل الاخرى.
وتدمير البروتينات في خلايا اللبائن وكذلك الإنسان يحصل عند ارتفاع الحرارة الى 43 – 45 م◦ وتقتل الخلايا تحت هذه الدرجة الحرارية ليس عن طريق الاضرار غير قابلة للرجوع وانما عن طريق سلسلة من التفاعلات المبرمجة تؤدي الى موت الخلايا، وفي هذه الحالة تقوم بروتينات الصدمة الحرارية بحماية الخلايا من القتل بالحرارة وذلك بالتداخل مع برنامج موت الخلايا. فموت الخلايا تحت ظروف غير متطرفة هو ما يعرف بالاستماتة، اما الخلايا التي تتعرض الى ارتفاع بسيط بدرجات الحرارة والتي تكون غير مميتة لكنها تموت بعد عدة انقسامات وتصبح غير قادرة على تكوين مستعمرات فيعرف بموت التكاثر Reproductive cell death او Colonogenic death وهذا المسار يختلف عن الاستماتة ولكنهما يشتركان في الاحداث الأولى لنقل الاشارات مثل زيادة ميوعة الأغشية الخلوية بالحرارة وغيرها.
مسار الموت والحياة بالصدمة الحرارية
في حقيقيات النواة الراقية فان الاجهاد الحراري بالإضافة الى حثه الاستجابة للصدمة الحرارية فانه يحث مسار الموت عن طريق تحفيز (JNK) c- Jun - NH2 – terminal وكذلك مسار البقاء عن طريق تحفيز Akt و ERK (المذكورة اعلاه). ومدى تحفيز هذه المسارات ونشاطها هو الذي يحدد مصير الخلايا المعرضة للحرارة. فتثبيط المسار JNK يؤدي الى اخماد الاستماتة، اما تثبيط مسار Akt و ERK فيقود الخلايا الى الاستماتة، ويمكن لمكونات المسار التداخل مع مسار الاستماتة وتعطيها والابقاء على الخلايا حية.
ويمكن للـ Hsp72 ان يمنع موت الخلايا من خلال اصلاحه للبروتينات الأساسية الحساسة للحرارة، كما انه يمنع الاستماتة بتثبيطه لبعض مكونات اجسام الاستماتة Apoptosomes.
ومن جهة اخرى يلاحظ ان الوصيفات وبروتينات الصدمة الحرارية من عائلة Hsp70 و Hsp90 تزداد في الخلايا التي هي ليست تحت الاجهاد وانما في حالة تكاثر ودورتها تسير بشكل عادي، وهذه البروتينات يمكن ان ترتبط بشكل وقتي مع الجزيئات الرئيسة العاملة في أنظمة السيطرة في دورة الخلية مثل P27/kip1 , p53 , pRb , Wee-1 , Cdk 4 وتساهم في تعين مواقع البروتينات، كما انها يمكن ان ترتبط بالبروتينات الفيروسية التي تصيب الخلايا. اضافة الى ان الوصيفات الجزيئية تعد من الوسائل الأساسية أثناء عمليات التخليق الحيوي للمايتوكوندريا.
لذلك فبروتينات الصدمة الحرارية والصغيرة منها على الأخص والتي تكون بحالة فسفرة مختلفة وتجمع قليل Oligomerization تساهم في أدوار معينة من عمليات تكاثر وتمايز الخلايا وتؤدي ادوارا مهمة في دورة الخلية. وكذلك البروتينات عالية الوزن الجزيئي مثل Hsp70 Hsp90 ترتبط ببروتينات أنظمة نقل الإشارات MAPK وبشكل خاص كاينيز Scr وترتبط بـ MEK. وتشارك في تكوين المعقدات غير المتحركة لجزيئات نقل الاشارات وهي تكوين المنصات Scaffolds التي تحدد وظيفة بعض البروتينات في مسارات نقل الاشارات مع الجزيئات المرسية المكيفات، كما ان الوصيفات تعمل على طوي البروتينات بشكل يلاءم وظيفتها في كل مسار.
اجهاد الاكسدة في حقيقيات النواة الراقية
هناك تشابه كبير في الخطوط العريضة للطرق المستعملة ضد الاجهاد التأكسدي بين البكتريا وحقيقيات النواة ومن أوجه التشابه :
• تمتلك خلايا بدائية وحقيقية النواة إنزيمات تحليل البيروكسيدات و SODs لغرض تدمير مركبات الاوكسجين الفعالة.
• جينات sod المنقولة من اللبائن يمكن ان يعبر عنها في البكتريا وتؤدي الى حماية كاملة للبكتريا التي ينقصها الانزيم SOD من تأثير O2-.
• تتشابه العديد من الانزيمات العاملة في عمليات الإصلاح للأضرار الناتجة من اجهاد الاكسدة.
ولكن الاختلاف يكمن في تنظيم الاستجابة ودرجة تعقيد الاستجابة. ففي البكتريا يكون الحاث هو المادة المؤكسدة نفسها او ما ينتج عن تداخل العامل المؤكسد مع احد مكونات الخلية. اما في اللبائن فان جذور الاوكسجين لا تحث انتاج المواد المضادة للأكسدة او الانزيمات العاملة وانما تحث تخليق بعض الانترلوكينات مثل TNF و IL – 1 . ومن الجدير بالذكر ان اغلب خلايا اللبائن توجد في بيئات لا يتذبذب فيها تركيز الاوكسجين ويبقى بحدود 4% في مصل الدم، ما عدا حالات تنشيط العدلات Neutrophiles لانتاج مركبات الاوكسجين الفعالة عند قتل الاحياء المرضية، وتنشيط العدلات يؤدي الى حث المواد المضادة للأكسدة ويكون TNF من المواد الحاثة القوية.
عوامل الاجهاد التأكسدي : يحدث الاجهاد عند التعرض للإشعاع القريب او القصير من أطوال الاشعة فوق البنفسجية او التعرض للإشعاع المؤين، او من ابتلاع مواد مولدة للجذور اي النشطة من ناحية الاكسدة والاختزال مثل الدواحر النباتية كما في مركب Psoralen في نبات الكرفس (Celery) او غيره من الأسباب.
وفي خلايا اللبائن ينتج عددا قليلا من البروتينات عند تعرضها للأشعة فوق البنفسجية ومنها انزيمات Heme – oxygenase , Glutathione transferase او غيره، ولكن بما ان الخلايا داخل اعضاء وأنسجة فهي لا تتعرض للأشعة فوق البنفسجية ولكنها تنتج هذه الانزيمات او البروتينات وهذا قد يشير الى ان المركبات الناتجة من التشعيع مثل بيروكسيد الهيدروجين او مركبات الاوكسجين الاخرى هي التي تكون من المواد الحاثة.
ومن المركبات الخطرة في الإنسان O2- الذي هو مادة مسرطنة قوية ويقوم بتنشيط وحث الجينات ذات العلاقة لتكوين المركبات الواقية ومن الجينات المستحثة c-fos , c-jun . c-myc, β-actin ونواتج الجينات هي عوامل انتساخ تقوم بتنظيم عمل الجينات المعينة.
ومن الآليات المضادة للأكسدة في اللبائن هو حث الانزيم Calmodulin kinase وزيادة أيون الكالسيوم الذي يساهم باليات مختلفة ضد الأكسدة. ان تركيز أيون الكالسيوم يزداد عندما يدمر الغشاء الخلوي والذي يؤدي بدوره الى تنشيط Phosphokinase C اذ يفسفر وقوم تنشيط انزيم Topoisomerase I . كما ان مركبات Phospholipid hyperperoxides التي تنتج من أكسدة دهون الأغشية الفوسفاتية تحفز انتاج العديد من الانزيمات مثل Glutathione peroxidase , Phospholipid hyperperoxide reductase , Phospholipase II اما الكسور التي تحدث لأشرطة DNA من جراء الاجهاد التأكسدي فانها تحفز بعض الانزيمات مثل Poly ( ADP- ribose ) polymerase ، وبروتينات اخرى مثل Topo I, Fos, Jum والوحدة الثانية α من انزيم DNAP . ولعل اهم البروتينات في كبح جماح الاجهاد التأكسدي هو Fos لذلك فهناك أكثر من مؤثر لتحفيزه، واكثر المحفزات Poly – ADP – ribosylated compoubds وكذلك يحفز بعوامل وعناصر الاستجابة الموجودة في المصل اضافة الى اشتراك cAMP في التحفيز.
وبلغة الارقام فان استجابة البكتريا لإجهاد الاكسدة يؤدي الى انتاج حوالي 60 بروتين او أكثر في حين ان خلايا اللبائن تنتج عدد قليل من البروتينات ولكن عمليات ومسارات التنظيم معقدة وبشكل كبير جدا.
اجهاد التنافذ
قد يسلط هذا الاجهاد على مجموعة صغيرة من الخلايا في الاحياء الراقية وهي خلايا الكى التي تقوم بتصفية السوائل الجسمية لذلك تتعرض لتراكيز عالية من المواد مما يؤثر على ثباتية كروموسومات مؤدية الى حث التشوهات الكروموسومية، اضافة الى حدوث تبادل الكروماتيدات الشقيقي (SCE) Sister chromatid exchange وحدوث كسور كروموسومية ولذلك فان هذا الاجهاد يمكن ان يؤدي الى تأخير دورة في الخلية وحدوث الاستماتة التي تحث بواسطة التراكيز الملحية العالية واليوريا خاصة في Renal medullary cells ، وتساعد الوصيفات وبروتينات الصدمة الحرارية من تخفيف الاجهاد على الخلايا الكلوية.
المصادر
الخفاجي , زهرة محمود (2008) . التقنية الحيوية الميكروبية (توجهات جزيئية ) . معهد الهندسة الوراثية والتقنية الحيوية . جامعة بغداد .

|
|
|
|
هل يمكن أن تكون الطماطم مفتاح الوقاية من السرطان؟
|
|
|
|
|
|
|
اكتشاف عرائس"غريبة" عمرها 2400 عام على قمة هرم بالسلفادور
|
|
|
|
|
|
|
جامعة الكفيل تقيم ندوة علمية عن الاعتماد الأكاديمي في جامعة جابر بن حيّان
|
|
|