


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 12-9-2019
التاريخ: 5-8-2018
التاريخ: 2023-08-26
التاريخ: 11-9-2019
|
الايزومر الهندسي Geometric isomerism
تختلف ايزومرات -2 البيوتين بعضها عن بعض فقط بطريقة ترتيب الذرات واتجاهها في الغراغ (ولكنها تتشابه من ناحية ارتباط الذرات إلى الذرات الاخرى)، وتنتسب هذه المركبات إلى صنف عام يسمى بالايزومرات الفراغية stereoisomers . الذي ينشأ من إمكانية وجود بنية فراغية غير متطابقة مع خيالها في المرآة. فهي إذاً ليست متخايلات* enantiomers تدعى الايزومرات الفراغية التي لا يكون احدها خيال الآخر في المرآة اللامتخايلات*diastereomers.
تدعى اللامتخايلات الخاصة التي تدين بوجودها للدوران المعاق حول الرابطة المزدوجة الايزومرات الهندسية geometric isomers. وتكون ايزومرات -2 البيوتين لا متخايلات وهي بالتالي ايزومرات هندسية.
لنتذكر ان ترتيب الذرات الذي يميز ايزومراً هندسياً معيناً يدعى التشكيل configuration . التشكيلات لــ 2 – البيوتينات الايزومرة هما البنيتان I و II. يفرق بين هذين التشكيلين في الاسم بإضافة البادئة سز (cis- من اللاتينية : في هذه الجهة) أو ترانس (trans – من اللاتينية: عبر) حيث تشير التسمية إلى ان زمرتي المتيل تقعان في نفس الجهة من الجزيء او في جهتين متعاكستين من الجزيء وهي الطريقة التي سنعتمدها لاحقاً في حيث يرمز للايزومر (ن. غ 4+ ْس) بالتشكيل – سز والايزومر (ن. غ + 1 ْس) بالتشكيل – ترانس.

يظهر الشكل 1.1 نماذج للايزومرات -2 البيوتين. نرى في الايزومر الترانس ان زمرتي المتيل منفصلتان عن بعض بشكل واضح بينما في الايزومر السز تكون متقاربة بشكل كاف مما يسبب ازدحاماً في الفراغ. وبناء على ذلك، يمكننا توقع ان الايزومر السز اقل استقراراً من الايزومر – الترانس وهو ما سنراه لاحقاً .

الشكل 1.1: نماذج الايزومر الهندسي لــ -2 البيوتين (أ) ترانس (ب) سز. لاحظ الازدحام بين زمرتي المتيل في الايزومر السز.
عادة تكون هنالك إعاقة دورانية حول أي رابطة مزدوجة كربون – كربون تؤدي إلى الايزومر الفراغي فقط عندما يكون هنالك علاقة معينة بين الزمر المرتبطة بذرات كربون الرابطة المزدوجة. يمكننا الحصول على هذه الايزومرات بوضع الاحتمالات المختلفة للبنى (ويكون من الأفضل استنتاجها باستخدام النماذج الجزئية). ثم نبحث بعد ذلك إذا كانت هذه البنى ايزومرات حقاً ام أنها مركبات متماثلة وعلى هذا الاساس نجد ان البروبيلين و 1 – البيوتين، والايزوبوتيلين ليست ايزومرات وتتوافق هذه النتيجة مع الحقائق ان كثيراً من الالكنات الاعلى يمكنها بالطبع ان تبدي ايزومراً فراغياً

وإذا درسنا مركبات اخرى غير الهيدروكربونات نجد ان 1 ، -1 ثنائي كلورو الايتن و 1 ، -1 برومو الايتن يجب ان لا يبدي خواصاً ايزومرية بينما يجب ان يبدي 1 ، -2 ثنائي كلورو الايتن و 1، -2 ثنائي برومو الايتن خواص ايزومرية ، وتكون هذه التوقعات صحيحة في كل الحالات المماثلة. لقد فصلت الايزومرات التالية اعتماداً على خواصها الفيزيائية.
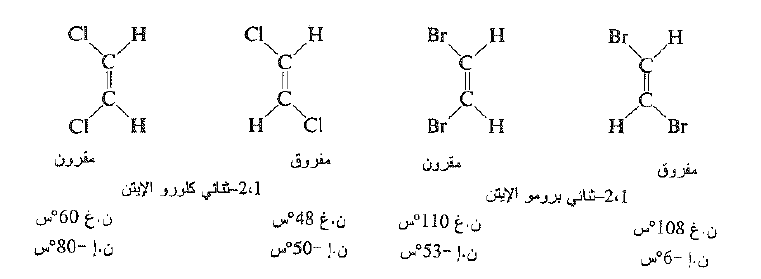
وعند فحصنا السابقة نستنتج ان الايزومر الهندسي لا يحدث في حالة ارتباط إحدى ذرتي الكربون بمجموعتين متماثلتين . وفيما يلي بعض التجمعات المحتملة.

إن ظاهرة الايزومر الهندسي عامة ويمكن أن نصادفها في اي نوع من المركبات التي تحوي روابط كربون – كربون مزدوجة (أو أي رابطة مزدوجة من نوع آخر).
يمكننا أن نستخدم البادئة سز – او ترانس – بشكل جيد لتمييز الايتيلينات ثنائية الاستبدال وبعض الايتيلينات ثلاثية الاستبدال ولكن كيف يمكننا تحديد التشكيلات المماثلة لما يلي:

ولكن أي المجموعات هي التقاط المرجعية ! بالنظر تباعاً إلى كل ذرة من ذرات الكربون المرتبطة بروابط مزدوجة نقوم بترتيب ذرتيهما او مجموعتيهما وفق تعاقب كاهان – انغولد – بلريلوغ. نأخذ بعد ذلك المجموع ذات الأفضلية الأكبر عند ذرة الكربون الأولى والمجموعة ذات الافضلية الأكبر عند ذرة الكربون الثانية ثم هل المجموعتان في نفس الجهة من الجزيء او في جهتين متعاكستين . من الواضح اننا نستخدم هذه الطريقة لتساعدنا في توصيف الجزيئات ، نستعمل الحرف Z ليدل على الوقوع في نفس الجهة من الجزيء، ويستخدم الحرف E ليدل على الوقوع في جهتين متعاكستين من الجزيء (من اللغة الالمانية zusarnmen تعني معاً و entgegen تعني متعاكس والحرف المناسب جزءاً من اسم الالكن مثل (Z) -1- برومو -1- كلورو البروين.
وهكذا يكون زوجان من الايزومرات الهندسية ، لا متخايلين. ان يتلاءمان مع خطة التصنيف الآخر، تلك الخطة القائمة على كيفية تحول الايزومرات الفراغية إلى بعضهما؟
هنالك كما رأينا:
(أ) ايزومرات تشكيلية: تتحول بينياً بالانقلاب (انقلاب من الداخل إلى الخارج. عند مركز كبرالي.
(ب) ايزومرات تهايؤية: تتحول بينياً بالدوران حول الروابط الاحادية.
وتصنف الآن:
(جـ) الايزومرات الهندسية : تتحول عملياً بالدوران حول الرابطة المزدوجة.
إن العملية المطلوبة (التدوير – هي نفسها التي تلزم في التحويل الداخل للايزومرات الهندسية والتهايؤية. ولكن من وجهة نظر العملية جداً للقدرة الايزومرية isolability، فإن الايزومرات الهندسية تكون أكثر قرابة للايزومرات التشكيلية:
يتطلب التحول الداخلي كسر الرابطة π في حالة الايزومرات الهندسية، وبالتالي تكون دائماً عملية صعبة. تتحول الايزومرات التهايؤية بوساطة عملية سهلة بالدوران حول الرابطة الاحادية.
نضع القاعدة الاساسية التالية للمناقشات وللمسائل الواردة في هذا الكتاب: ما لم يقل عكس الامر بصورة واضحة فإن المصطلحات ايزومرات فراغية ومتخايلات ولا متخايلات سوف تشير فقط إلى الايزومرات التشكيلية والايزومرات الهندسية وسوف نستثني الايزومرات التهايؤية. وسوف نقول عن الأخيرة إنها ايزومرات تهايؤية او تهايؤ او متخايلات تهايؤية او لا متخايلات تهايؤية.
تبين من كل ما سبق بالنسبة للخواص الكيميائية والفيزيائية ان الايزومرات فيما بينها ذات العلاقة التي تصادف في اللامتخايلات* المدروسة في فهي تحتوي على نفس الزمر الوظيفية وبالتالي تظهر خواصاً كيميائية متشابهة ولكن خواصها الكيميائية لا تكون متماثلة، على كل حال، لأن بناها ليست متماثلة وكذلك لبست بعضها خيالاً في المرآة فهي تتفاعل مع نفس الكواشف، ولكن بسرعات مختلفة. يمكن للايزومرات الهندسية تحت شرؤوط محددة – ومخاصة في المنظومات البيولوجية – ان تختلف في سلوكها الكيميائي .
وكما تظهر الأمثلة المذكورة سابقاً فإن الايزومرات الهندسية تمتلك خواصاً فيزيائية مختلفة: فهي تختلف في نقاط الفيزيائية فإنه يمكن تمييزها عن بعضها كما يمكن تعيين مقدارها؛ وعلى أساس هذه الاختلافات في الخواص الفيزيائية يمكننا على الأقل من حيث المبدأ فصلها.
*اللامتخايلات = اضداد بصرية
*المتخايلات = انداد بصرية



|
|
|
|
لمكافحة الاكتئاب.. عليك بالمشي يوميا هذه المسافة
|
|
|
|
|
|
|
تحذيرات من ثوران بركاني هائل قد يفاجئ العالم قريبا
|
|
|
|
|
|
|
العتبة العباسية تشارك في معرض النجف الأشرف الدولي للتسوق الشامل
|
|
|