


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 17-1-2016
التاريخ: 7-1-2016
التاريخ: 2024-07-31
التاريخ: 2025-01-27
|
نظرية التجربة : المعادلة التالية تعبر عن تفاعل الفوق كبريتات (البير كبريتات) مع اليوديد: K2S2O8 + 2KI→ 2K2SO4 + I2
هذا التفاعل يعتبر من الرتبة الثانية ولكن في حالة وجود تركيز كبير من اليوديد بالمقارنة مع فوق الكبريتات فإن كمية اليوديد المستهلكة في التفاعل تكون ضئيلة يمكن إهمالها وعلى ذلك يصبح معدل التفاعل معتمدا فقط على تركيز مادة واحدة هي فوق الكبريتات وبذلك يمكن اعتبار التفاعل السابق تحت هذه الظروف هو تفاعل من الرتبة الأولى ويعرف هذا النوع من التفاعلات بتفاعل الرتبة الأولى الكاذبة Pseudo-first order ، والمعادلة التي تعبر عن تفاعلات الرتبة الأولى هي:
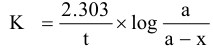
حيث a هو التركيز الابتدائي لفوق الكبريتات X هي الكمية المتفاعلة من اليوديد أو اليود المتكون.
المواد المستخدمة:
1- يوديد البوتاسيوم (M0.2)
2-فوق كبريتات البوتاسيوم (M0.005)
3- ثيوكبريتات الصوديوم ( M0.01).
4- دليل النشا.
5- ماء مقطر بارد
الأدوات المستخدمة:
1- دورق تفاعل (زجاجة محاليل).
2- سحاحة.
3-دورق مخروطي.
4- ماصة مدرجة سعة 10 مل.
5- حمام مائي.
6- محرار.
7- مخبار سعة 50 مل.
8- ساعة إيقاف.
خطوات التجربة :
1- انقل 50 مل من محلول يوديد البوتاسيوم (0.2 M) إلى زجاجة المحاليل ثم أضف إليها 50 مل من محلول فوق كبريتات البوتاسيوم وشغل ساعة الإيقاف مع غلق الزجاجة جيداً حتى لا يهرب اليود.
2- بعد مرور 5 دقائق انقل بالماصة 10مل من مخلوط التفاعل إلى دورق مخروطي يحتوي على حوالي 20مل من الماء البارد ودليل النشا .
3- عاير اليود المتكون باستخدام ثيو كبريتات الصوديوم (0.01) حتى نقطة النهاية وسجل حجم ثيو كبريتات الصوديومVt المكافئة لليود المتكون أي x
4- كرر الخطوتين السابقتين عندما يكون الزمن (35,30,25.20,15,10) دقيقة وما يقابلها من الحجم Vt.
5- بعد ذلك سخن الجزء المتبقي من مخلوط التفاعل إلى 60م ْ لمدة 15 دقيقة في حمام مائي مع ابقاء غطاء زجاجة المحاليل مغلقة ، ثم برد إلى درجة حرارة الغرفة.
6- اسحب 10 مل من مخلوط التفاعل وعايره مع ثيو كبريتات الصوديوم وسجل حجم Vα وهو الحجم المكافئ للتركيز الابتدائي a
الحسابات :
1- حيث إن (حجم الثيو كبريتات عند أزمنة t) يكافئ كمية فوق الكبريتات المتفاعلة x وVα (حجم ثيو كبريتات الصوديوم المكافئة للتركيز الابتدائي a) فإنه يمكن كتابة المعادلة التي تعبر عن تفاعل من الرتبة الأولى على النحو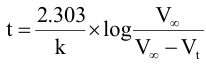
2- سجل النتائج في جدول
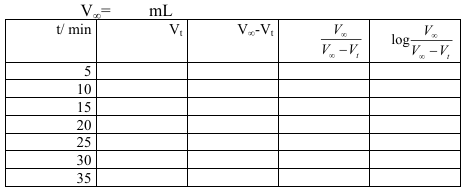
3-ارسم العلاقة بين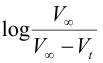 المحور الصادي مع الزمن t (المحور السيني).
المحور الصادي مع الزمن t (المحور السيني).
4- عين ميل الخط المستقيم الناتج ومنه احسب ثابت معدل سرعة التفاعل k .
Slope =2.303/ k
5- أحسب زمن نصف العمر t1/2:
t1/2=0.693/k



|
|
|
|
خطر خفي في أكياس الشاي يمكن أن يضر صحتك على المدى البعيد
|
|
|
|
|
|
|
دراسة تكشف عن حياة "غريبة" في أعماق الأرض
|
|
|
|
|
|
|
العتبة العلويّة المقدّسة تقيم فعالية العرض المسرحي "سيد الكلام" احتفاءً بذكرى ولادة أمير المؤمنين (عليه السلام)
|
|
|