

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
تركيز المادة الأساس : Substrate Concentration
المؤلف:
أ.د.عيسى عبد السعداوي
المصدر:
الكيمياء الحيوية النظري
الجزء والصفحة:
ص 201
20-4-2016
33771
تركيز المادة الأساس : Substrate Concentration
لوحظ العديد من الدراسات التي اجريت على التفاعلات الأنزيمية، ان سرعة التفاعل تزداد مع زيادة تركيز المادة الأساس بشكل طردي، عندما يكون تركيز المادة الأساس منخفضا نسبياً. وعند زيادة تركيز المادة الاساس بشكل كبير فإن سرعة التفاعل تصبح ثابتة، ولا يلاحظ اي زيادة في سرعة التفاعل بزيادة تركيز الأساس. ويمكن ملاحظة ذلك من الشكل التالي :


الشكل أعلاه يوضح طبيعة العلاقة بين تركيز المادة الاساس (S) وسرعة التفاعل الابتدائية (Vi).
لقد وضح هذه العلاقة كل من ميكاليس ومنتن (Michales – Menton) بافتراض ان الخطوة الأولى في أي تفاعل انزيمي تتلخص بالتقاء المادة الأساس (S) مع الأنزيم (E) لتكوين المعقد الوسطي (ES) والذي يمكن ان يتفكك مرة اخرى لإعطاء الانزيم والمادة الاساس كما هو موضح في المعادلة التالية :


أو تتحول المادة الأساس (S) الى ناتج التفاعل والذي ينفصل عن الأنزيم وكما في المعادلة التالية :


عند فرض تكون المعقد في الخطوة الأولى يكون أسرع من تحول المعقد الى ناتج التفاعل فان الخطوة الثانية هي التي سوف تحدد سرعة التفاعل، وهذا يعني ان سرعة التفاعل في اي لحظة من وقت التفاعل تتناسب طردياً مع تركيز معقد الأنزيم مع المادة الأساس :
V α (ES)
V = K3 (ES)
ومن هذا الافتراض يمكننا الاستدلال بتأثير تركيز المادة الاساس على سرعة التفاعل. عندما يكون تركيز المادة الأساس منخفضا فإن احتمال اتحاده بالأنزيم لتكوين المعقد يكون ضعيفا وبالتالي يكون سرعة التفاعل قليلة، أما عند زيادة تركيز المادة الاساس فإن فرصة التقائه بالأنزيم تكون عالية وبذلك تزداد سرعة التفاعل الى ان تصل الى الحد الذي تصبح فيه جميع جزيئات الأنزيم مرتبطة مع المادة الاساس أي يصبح الأنزيم مشبعاً بجزيئات المادة الأساس، وتصل قيمة (ES) الى أعلى قيمة ممكنة لها، وتصل سرعة الأنزيم الى قيمتها القصوى. واعتماداً على هذا الافتراض يمكن اقامة العلاقة الرياضية بين تركيز المادة الأساس وسرعة التفاعل، والذي يعبر عنه بالمعادلة المعروفة بمعادلة ميكاليس ومنتن :
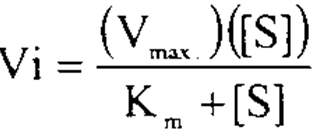

حيث تمثل (Vi) السرعة الابتدائية للأنزيم و (V max) تمثل السرعة القصوى عندما يكون تركيز المادة الأساس عالياً، وهي قيمة ثابتة في ظروف محددة من درجة الحرارة والحموضة وتركيز الأنزيم و (S) يمثل تركيز المادة الاساس عند بداية التفاعل. اما (Km) فهو مقدار ثابت ويعرف بثابت ميكاليس ومنتن.
يلاحظ من المعادلة ان وحدات ثابت ميكاليس ومنتن هي عبارة عن وحدات تركيز المادة الأساس. ومن هذا يمكننا تقدير العلاقة بين سرعة التفاعل وتركيز المادةالاساس في حالات مختلفة. فعندما يكون تركيز المادة الأساس (S) قليلاً بالمقارنة مع ثابت ميكاليس (Km) عندها يمكن اهمال قيمة تركيز المادة الأساس (S) في مقام المعادلة السابقة فتصبح العلاقة :

وكما هو معروف فإن قيمة كل من (Km) و V max)) ثابتة، لذلك يمكننا وضع ثابت جديد بديلا من (Km) /V max)) وليكن الثابت K فتصبح المعادلة في أعلاه :
V = K (S)
وهذه المعادلة الاخيرة توضح بأن العلاقة بين سرعة التفاعل وتركيز المادة الأساس (S) هي علاقة طردية.
اما عند الحالات التي يكون فيها تركيز المادة الأساس (S) عالية بالمقارنة مع ثابت ميكاليس (Km)، فبالإمكان إهمال قيمة (Km) في المقام تصبح العلاقة :
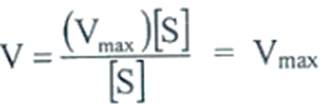

أي أن سرعة التفاعل تبدو ثابتة، اي لا علاقة لها بتركيز المادة الأساس (S).
اما اذا كان تركيز المادة الأساس (S) مساوياً الى ثابت ميكاليس (Km) فإن المعادلة عندها تصبح :


أي ان سرعة التفاعل في هذه الحالة تساوي نصف قيمة السرعة القصوى. ومن هذا الافتراض يصبح معنى ثابت ميكاليس (Km) معروفا وواضحاً. ويمكن تعريفه بأنه تركيز المادة الأساس (S) الذي تكون عنده سرعة التفاعل مساوية لنصف السرعة القصوى.
فإذا طبقنا ذلك على الرسم البياني الذي يحدد العلاقة بين تركيز المادة الأساس (S) وسرعة التفاعل فإننا نبدأ بتحديد السرعة القصوى ثم تحديد نقطة نصف السرعة القصوى ومن ثم نستطيع تحديد تركيز المادة الأساس عند تلك النقطة.
ان قيمة ثابت ميكاليس (Km) لا تتغير بتغير تركيز المادة الأساس (S) أو تركيز الأنزيم (E)، لكنها قد تتغير بتغير درجة الحرارة، ودرجة الحموضة.
اما عند الحالات التي يمكن للأنزيم فيها ان يعمل على أكثر من مادة أساس (S) فان قيمة (Km) تختلف باختلاف المادة الأساس. وقد لوحظ ان تقدير سرعة التفاعل باستخدام معادلة ميكاليس ومنتن المبنية على أسس نظرية يتفق مع النتائج المختبرية في كثير من الحالات، مما يؤكد صحة ما وضع من الفرضيات حول خطوات التفاعل الأنزيمي.
 الاكثر قراءة في الانزيمات
الاكثر قراءة في الانزيمات
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















