

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
الأنزيمات المنظمة – الأنزيمات الألوستيرية
المؤلف:
أ.د.عيسى عبد السعداوي
المصدر:
الكيمياء الحيوية النظري
الجزء والصفحة:
ص 198
19-4-2016
14500
الأنزيمات المنظمة – الأنزيمات الألوستيرية :
(Regylatory Enzymes – Allosteric Enzymes)
لاحظنا ان معظم الأنزيمات تحتوي على أكثر من وحدة بروتينية في جزيئة، الا ان هنالك مجموعة من الانزيمات تحتوي على أكثر من وحدة بروتينية في جزيئة ولكل وحدة من هذه الوحدات البروتينية موقع فعال، لذلك يمكن لعدد من جزيئات المادة الاساس (الهدف) مساو لعدد المواقع الفعالة ان ترتبط في الوقت نفسه على سطح جزيئة الانزيم ويؤدي هذا الارتباط بين جزيئات المادة الاساس (الهدف) واحدى وحدات الأنزيم الى تغييرات تركيبية في البناء الهيكلي لبقية الوحدات في الجزيئة الأنزيمية (Conformational Changes) فتتغير بذلك قدرة الأنزيم على الارتباط مع المادة الأساس.
وتسمى هذه الظاهرة بظاهرة الارتباط التعاوني (Cooperative binding) بسبب ان ارتباط المادة الاساس مع احدى الوحدات في تركيب الانزيم يؤثر على الوحدات الاخرى. ان هذا التأثير يمكن ان يكون ايجابيا اذا ازدادت قدرة الوحدات الاخرى على الارتباط مع المادة الاساس (الهدف)، وقد يكون التأثير سلبياً اذا قلت قدرة هذه الوحدات في الارتباط بالمادة الأساس. ان العلاقة بين سرعة تفاعل الأنزيم وتركيز الهدف في هذه الانزيمات تختلف مما هو في الانزيمات العادية التي تتبع نموذج ميكلس – منتن، وكما هو موضح في الشكل التالي :
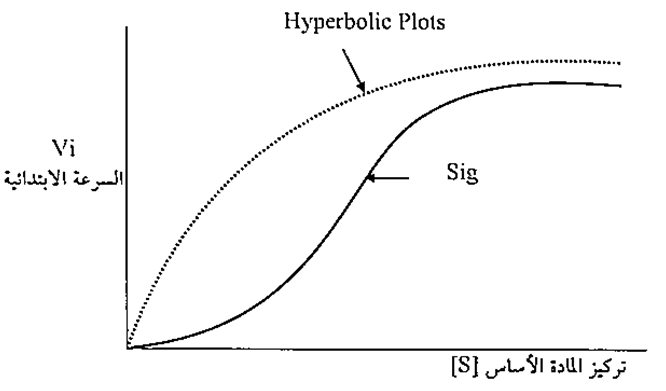

العلاقة بين سرعة التفاعل وتركيز المادة الاساس
(الخط المنقط يمثل الانزيمات العادية، والخط المتصل يمثل الانزيمات الأولستيرية)
تحتوي كل وحدة من وحدات الانزيمات الأولستيرية (الانزيمات المنظمة) على موقع آخر غير الموقع الفعال المخصص للارتباط بالمادة الاساس، ولذلك فهي تسمى بالأنزيمات ذات الموقع الآخر. ان هذه المواقع مهيئة للاتحاد مع المركبات الكيميائية بروابط ضعيفة غير تساهمية، يؤدي هذا الارتباط بتلك المركبات الكيميائية الى تغيير نشاط الانزيم سلبيا او ايجابياً، لذلك فإن هذه المركبات الكيميائية تسمى بالمعدلات (Modifiers)، فتسمى المعدلات التي تزيد من نشاط الانزيم بالمنشطات (Activators)، وتلك التي تؤدي الى اضعاف نشاط الانزيم بالمنشطات (Inhibitors).
ان بعض المعدلات الانزيمية لها علاقة بالمسار الايضي الذي يساهم فيه الانزيم الأولستيري، وهي بتلك اي المعدلات تحمل اشارة لتنظيم فعالية الأنزيم، مما يؤدي بالتالي الى تنظيم المسار الايضي، فقد يكون الناتج النهائي للمسار الأيضي مثلاً مثبطاً لفاعلية الأنزيم الأول في ذلك المسار فيحدث بذلك التثبيط بالتغذية الراجعة (Negative Feedback inhibition).
من الامثلة على هذا النمط من التنظيم تأخذ انزيم الاسبارتات ترانس كرباميليز (Aspartate transcarbamoylase) ان هذا الانزيم ذو الموقع الآخر يحفز الخطوة الأولى في صناعة البريميدينات، فالناتج النهائي (CTP) النيوكلوتيد البريميدبني والذي يتكون كحصيلة لعدد من التفاعلات يعمل مثبطا لعمل الأنزيم المذكور، ومن جهة اخرى يعمل النيوكلوتيد البيوربني (ATP) على تنشيط عمل هذا الانزيم. وفي كلتا الحالتين يتم التنظيم بعد أن يرتبط احد المركبين على الموقع الآخر للأنزيم. وتساعد هذه الآلية على تنظيم كمية (CTP) وجعلها متوازنة مع كمية (ATP).
 الاكثر قراءة في الانزيمات
الاكثر قراءة في الانزيمات
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















