


 الفاكهة والاشجار المثمرة
الفاكهة والاشجار المثمرة
 نخيل التمر
نخيل التمر
 الحمضيات
الحمضيات 
 الاشجار ذات النواة الحجرية
الاشجار ذات النواة الحجرية
 المحاصيل
المحاصيل
 المحاصيل البقولية
المحاصيل البقولية
 محاصيل الالياف
محاصيل الالياف
 محاصيل زيتية
محاصيل زيتية
 محاصيل الحبوب
محاصيل الحبوب 
 محاصيل الخضر
محاصيل الخضر
 القرعيات
القرعيات 
 المحاصيل المنبهة و المحاصيل المخدرة
المحاصيل المنبهة و المحاصيل المخدرة
 المحاصيل السكرية
المحاصيل السكرية 
 نباتات الزينة والنباتات الطبية والعطرية
نباتات الزينة والنباتات الطبية والعطرية
 الحشرات النافعة
الحشرات النافعة
 النحل
النحل 
 دودة القز(الحرير)
دودة القز(الحرير)
 تقنيات زراعية
تقنيات زراعية
 التصنيع الزراعي
التصنيع الزراعي 
 الانتاج الحيواني
الانتاج الحيواني 
 الطيور الداجنة
الطيور الداجنة
 الاسماك
الاسماك
 الابقار والجاموس
الابقار والجاموس
 الاغنام
الاغنام 
 آفات وامراض النبات وطرق مكافحتها
آفات وامراض النبات وطرق مكافحتها 
 الحشرات
الحشرات 
 امراض النبات ومسبباتها
امراض النبات ومسبباتها 
 الحشائش والنباتات الضارة
الحشائش والنباتات الضارة | تشخيص فايروسات النبات (التشخيص المصلي (السيرولوجي) لفايروسات النبات) |
|
|
|
أقرأ أيضاً
التاريخ: 20-6-2018
التاريخ: 3-7-2018
التاريخ: 29-6-2018
التاريخ: 20-6-2018
|
تشخيص فايروسات النبات (التشخيص المصلي (السيرولوجي) لفايروسات النبات)
يعد تشخيص الأمراض الفايروسية والكشف عن الفايروسات المسببة من المهام الرئيسة التي يقوم بها المختصون في هذا المجال وذلك لأنه لا يمكن وضع أي برنامج مكافحة لأي مرض فايروسي على أي محصول من دون معرفة نوع الفايروس المسبب كذلك فإن التشخيص يعد ضروريا لأغراض تصنيف الفايروسات ودراستها على المستوى الجزيئي إلا أن تشخيص الأمراض الفايروسية ليست بالعملية السهلة بل تعد إحدى المعضلات التي تواجه المختصين في هذا المجال وذلك للأسباب الأتية (1) تباين الأعراض التي يسببها النوع الفايروسي الواحد بتباين العائل النباتي وسلالة الفايروس والظروف البيئية وخاصة الحرارة والضوء مما يسبب عدم استقرارية الأعراض وبالتالي صعوبة التشخيص الابتدائي الحقلي (2) شيوع ظاهرة الإصابات الكامنة Latent infections والإصابات المختفية Masked infections أي عدم ظهور أية أعراض خارجية على النبات المصاب رغم وجود الفايروس فيه بتركيز عالي (3) تماثل عدد من الأعراض الفايروسية مع أعراض تسببها العديد من المسببات ومنها تغذية بعض أنواع الحشرات ونقص العناصر والتسمم بالمبيدات (4) تماثل الأعراض التي تسببها العديد من الأنواع الفايروسية المختلفة على النوع النباتي الواحد (5) صغر حجم الفايروسات وعدم إمكانية رؤيتها إلا بالمجهر الالكتروني الذي لا يتوفر بسهولة في كل المختبرات لغلاء ثمنه (6) عدم إمكانية تربية فايروسات النبات على أوساط زرعيه خارج النسيج الحي كما هو الحال مع الفطريات والبكتريا الممرضة للنبات (7) غلاء أسعار المصول المضادة والمواد الكيميائية والمعدات المستعملة معها للتقانات التشخيصية الحديثة وحصر إنتاجها بعدد قليل من المؤسسات مما يحرم الكثير من الباحثين وخصوصا في دول العالم الثالث من الحصول عليها للتشخيص السريع للفايروسات.
التشخيص المصلي (السيرولوجي) لفايروسات النبات
هي إحدى أهم طرق تشخيص الفايروسات المعتمدة الأن عالميا والتي سهلت عملية التشخيص بشكل كبير حيث تمتاز بسرعتها ودقتها العالية وتتلخص مميزاتها بما يأتي: (1) الكشف عن الفايروسات مباشرة وهي في العصير النباتي الخام بوجود الشوائب النباتية (2) الحصول على نتائج التشخيص خلال 3-24 ساعة حسب نوع التقانة المصلية المستعملة مقارنة بمدة أيام – أسابيع عند اللجوء إلى طريقة التشخيص بالنباتات الكاشفة (3) تمتاز عدد من التقانات المصلية الحديثة ومنها الأليزا واختبار البصمة المناعية بحساسيتها العالية مما يمنحها إمكانية الكشف عن الفايروس في النبات حتى وإن كان بتركيز منخفض جدا فيه (4) سهولة تشخيص الفايروسات التي لا تنقل ميكانيكيا والتي لم يكن بالإمكان تشخيصها بالنباتات الكاشفة (5) وفرت إمكانية التشخيص المسحي السريع لعدد كبير من العينات في وقت واحد مما ساعد في إجراء الدراسات الوبائية الفايروسية وكذلك الفحص السريع للشحنات الزراعية في المحاجر الزراعية (6) سهولة شحن المصول وخزنها لفترات زمنية طويلة قد تصل لمدة سنة أو أكثر تحت التبريد مما سهل كثيرا من تداولها (7) تتيح إجراء الدراسات التصنيفية للفايروسات من خلال تحديد العلاقة المصلية بين الفايروسات المختلفة ودراسة تركيب الفايروس ونشاطاته الحيوية داخل خلايا العائل.
1. الأضداد
الأضداد Antibodies هي بروتينات مناعية جلوبيولينية lgs , Immunoglobulins يكونها الجهاز المناعي في الحيوانات اللبونة وهي على خمسة أنواع (1) "الجلوبيولين المناعي - جي IgG (2) "الجلوبيولين المناعي - إم" IgM (3) "الجلوبيولين المناعي - إي" IgE (4)"الجلوبيولين المناعي – أي" IgA (5) "الجلوبيولين المناعي – دي" IgD، ويعد الضد IgG هو الأهم والوحيد الفعال في الاختبارات المصلية بسبب خصوصية ارتباطه بالبروتينات الفايروسية ويتكون من سلسلتي عديد ببتيد ثقيلتان Heavy chains بشكل حرف Y وأخريتان خفيفتان Light Chains ويبلغ الوزن الجزيئي للثقيلة خمسة كيلودالتون وللخفيفة اثنان كيلودالتون وترتبط هذه السلاسل مع بعضها بأواصر ثنائية الكبريت S-S-bonds والتي توجد أيضا داخل السلاسل لتدعم بنائها وتعطيها الثباتية المطلوبة.
يتكون الطرف الأميني لكل من السلسلتين الثقيلة والخفيفة من تعاقبات أمينية متغايرة Heterogeneous sequence لذا يطلق عليها مصطلح "المنطقة المتغايرة" V) Variable region) وترتبط هاتين المنطقتين في السلسلتين الثقيلة والخفيفة لتكوين "منطقة ربط المستضد" Antigen-binding Site وأن التغير المستمر في تركيب هذه المنطقة هو الذي يوفر مرونة تركيبية لظهور أشكال ارتباطية متعددة قادرة على الارتباط مع جسيمات المستضد (الفايروس) أما الطرف الأخر للسلسلتين فيسمى "الجزء الثابت" FC) Constant fragment)، (الشكل 1)، تنتج هذه الأضداد في أجسام الحيوانات اللبونة ذات الجهاز المناعي المتطور من قبل خلايا مناعية لمفية متخصصة تسمى الخلايا البائية B-lymphocytes.
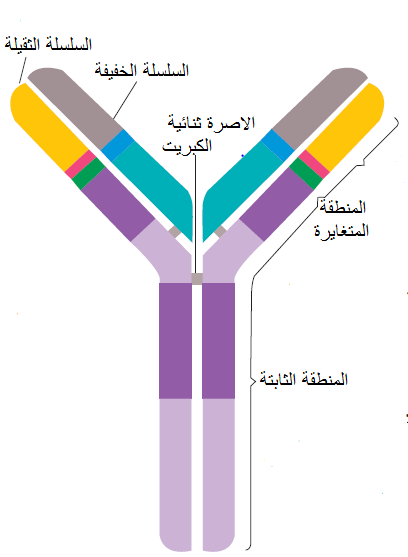
الشكل (1): مخطط للضد IgG يبين السلسلتين الثقيلة والخفيفة والمنطقتين المتغايرة والثابتة.
الشكل مقتبس من Mahy و Van Regenmortels (2008).
2. المستضدات (الأنتجينات)
المستضدات Antigens وتسمى أيضا "العوامل الممنعة Immunizing agents هي أية جسيمات بروتينية أو سكرية معقدة يزيد وزنها الجزيئي عن 10 كيلودالتون تحفز الجهاز المناعي في الحيوانات الفقارية واللبونة، وتعد المستضدات البروتينية هي الأكثر كفاءة في استحثاث الجهاز المناعي لإنتاج الأضداد التي ستتفاعل تخصصيا معها وتسمى هذه الخاصية "القدرة الإمناعية للمستضد" Immunogenicity كما تمتلك المستضدات قدرة الارتباط مع الأضداد المتخصصة عليها ويطلق على ذلك مصطلح "القدرة الإستضادية" Antigenicity، وحيث أن فايروسات النبات هي جسيمات عالية الوزن الجزيئي نسبيا وتحوي نسبة عالية من البروتين تتراوح بين 75-95 % من كتلتها لذا فهي مستضدات فعالة في تحفيز الجهاز المناعي وإنتاج الأضداد والكابسيد هو المستضد الفعال إلا أن الوحدات البنائية البروتينية المكونة له تستحث أيضا الجهاز المناعي ولكنها أقل قدرة إمناعية منه بسبب صغر حجمها.
يرتبط الفايروس مع الضد في منطقة ارتباط موجودة على سطح المستضد يطلق عليها "المحدد المستضدي" Antigenic determinant أو تسمى Epitope والمتكونة من تعاقب معين للأحماض الأمينية في الفايروسات البسيطة وقد تكون منطقة الارتباط في الفايروسات المعقدة مكونة من بروتين وكاربوهيدرات. يعتمد التفاعل المصلي بين الفايروسات وأضدادها على الصفات التركيبية لبروتين الغطاء ووحداته البروتينية ولكن أمكن عمليا إنتاج أضداد فايروسية باستعمال البروتينات الوظيفية الفايروسية، توجد المحددات المستضدية بعدة أنواع في فايروسات النبات وهي (1) "المحددات المستضدية الخيطية المستمرة" Continuous epitopes وتكون بشكل سلسلة من الأحماض الأمينية غير المتفرعة المنقبضة Linear stretch، وهي الأكثر شيوعا (2) "المحددات المستضدية الخيطية المتفرقة" Discontinuous epitopes او تسمى " المحددات المستضدية المحدثة" Neotopes والتي تتكون من عدد من سلاسل الأحماض الأمينية المتباعدة مكانيا ولكنها تتقارب بسبب الالتفاف الذي يحصل في تلك السلاسل (3) "المحددات المستضدية المختفية" Cryptotopes وهي التي لا تظهر إلا حين تفكك (دنترة) المستضد (4) "المحددات المستضدية المتحولة" Metatopes وهي التي تظهر عندما يتبلمر أو يتفكك المستضد، إن تباين وتنوع المحددات المستضدية على سطح الفايروس هو الذي يعطي للأضداد متعددة النسيلة قدرة الارتباط المتنوعة أي قدرتها على التفاعل مصليا مع أنواع عدة من الفايروسات المتقاربة تصنيفيا، ووجد أن مساحة سطح البروتين الفايروسي الذي تتحسسه جزيئة الضد هي التي تحدد نوع المحدد المستضدي الذي تتعامل معه فإذا كانت مساحة سطح البروتين بحدود 2.5 * 2 نانومتر فان نوع المحدد المستضدي الذي تتعامل معه هو من النوع المتفرق.
3. الارتباط التخصصي بين الفايروسات والضد IgG
يرتبط الضد IgG ارتباطا تخصصيا ثنائيا Divalent من منطقته المتغيرة مع الجسيمة الفايروسية المتخصص عليها أي أن كل جزيئة ضد لها قدرة ارتباط مع جسيمتين فايروسيتين فقط، بينما تكون الجسيمة الفايروسية متعددة الارتباط Multivalent أي لها قدرة الارتباط مع عدد كبير من الأضداد بسبب امتلاكها لعدة مناطق ارتباط وهي المحددات مستضدية الموجودة على سطحها، (الشكل 2) وهو ارتباط تخصصي تحكمه الأشكال المكانية ثلاثية الأبعاد للأحماض الأمينية في كل من الضد والفايروس والتي تربط بأواصر غير تساهمية وهي (1) الأصرة الهيدروجينية Hydrogen bond (2) الأصرة الكهربائية المستقرة Electrostatic bond (3) الاصرة الكاره للماء Hydrophobic bond (4) اصرة فاندارفالس Vander Waals bond، ومثال ذلك فان كابسيد فايروس موزائيك التبغ (TMV) يتكون من 2100 وحدة بروتينية وبذلك يمكن نظريا اعتبار كل منها محدد مستضدي مستقل عليه يمكن أن يرتبط بالجسيمة الفايروسية 2100 جزيئة ضد إلا أنه من الناحية العملية فان العدد الحقيقي الذي يرتبط بالفايروس هو أقل بكثير من العدد المذكور وذلك بسبب تزاحم جزيئات الأضداد على المحددات المستضدية. يعبر عن طبيعة الارتباط بين الضد والمستضد بحالتين هما (1) حالة الألفة Affinity وهي مقياس لقوة الارتباط بين محدد مستضدي واحد وجزيئة ضد واحدة وهذا الارتباط هو ارتباط رجعي يمكن أن ينفك وأن الأضداد عالية الألفة هي ذات الأداء الأفضل مصليا (2) حالة الشراهة Avidity وهي مقياس لمجموع حالات الارتباط بين كل المحددات المستضدية الموجودة على سطح الفايروس مع الأضداد المرتبطة بها وبذلك فان الشراهة هي مقياس للثباتية الكلية لمعقد الضد – المستضد وهي تتأثر بحالة الألفة القائمة بينهما وأيضا بالترتيب الهندسي للأسطح المترابطة بين الضد والمستضد، وهكذا فان الألفة هي جزء من الشراهة. عندما ترتبط الجسيمات الفايروسية مع الأضداد المتخصصة عليها فإنها تكون راسبا شبكيا Lattice precipitate حيث تعمل الأضداد بمثابة جسور رابطة بين الجسيمات الفايروسية المنتشرة في المحلول وتترسب بسبب ظهور المجاميع الكاره للماء واختفاء المجاميع المحبة للماء على الأسطح البروتينية للجسيمات الفايروسية بعد ارتباطها بالأضداد وهذا هو الأساس الذي تقوم عليه تفاعلات الترسيب المصلية، إن الكابسيد هو المسئول عن تحفيز الجهاز المناعي للحيوانات اللبونة وتكوين الأضداد وليس الحامض النووي لذا فانه لا يمكن التمييز مصليا بين الفريون والكابسيد الفارغ ولكن وجد أن الفريون هو ذو قدرة إمناعية أعلى من الكابسيد الفارغ مما يدل على دور الحامض النووي في زيادة ثباتية الفايروس وبالتالي زيادة قدرته الإمناعية.

الشكل (2): ارتباط جسيمتين بلوريتين للفايروس التابع لفايروس موت التبغ (STNV) مع جزيئات الضد IgG مصورة بالمجهر الالكتروني لتكوين معقد الفايروس - الضد".
الشكل مقتبس من Hull (2002).
4. أنواع المصول المضادة
يوجد نوعين من المصول المضادة المستعملة في تشخيص فايروسات النبات وذلك حسب نوع الأضداد التي تحتويها وهما:
(1) المصل ذو الأضداد متعددة النسيلة , PAB Polyclonal antibodies والذي يحوي أضدادا خليطة تتفاعل مع أكثر من سلالة فايروسية لنفس النوع الفايروسي أو مع أكثر من نوع فايروسي من الأنواع المتقاربة مصليا وذلك لأن تنوعها الخليط سمح لها بالتفاعل مصليا مع كل المحددات المستضدية الموجودة على سطح الجسيمات الفايروسية المتخصصة عليها. (2) المصل ذو الأضداد وحيدة النسيلة , MAB Monoclonal antibodies والذي يحوي أضدادا نقية تتفاعل مع سلالة فايروسية واحدة أو مع نوع فايروسي واحد وذلك بسبب تخصصيتها على محدد مستضدي واحد موجود على سطح الجسيمات الفايروسية المتخصصة عليها.
تقاس كفاءة المصل المضاد سواء كان متعدد أو وحيد النسيلة في تشخيص الفايروس بمعرفة "تركيز المصل المضاد" Titer وهو عبارة عن درجة التخفيف النهائية للمصل المضاد أي أعلى درجة تخفيف ممكنة للمصل مع احتفاظه بقدرته على التفاعل المصلي مع الفايروس المتخصص عليه وهو أيضا مقياس نسبي لتركيز الضد IgG في المصل المضاد.
تعتمد أفضلية كل من المصل المضاد متعدد أو وحيد النسيلة في التشخيص على الهدف التشخيصي المراد تحقيقه فالمصل أحادي النسيلة هو الأفضل لتشخيص السلالات الفايروسية لأنه أكثر تخصصا من الأول الذي لا يميز بين سلالات النوع الفايروسي ولكن وجد أن بعض أنواع المصول أحادية النسيلة مثل تلك المنتجة ضد فايروسات Polyviruses تتفاعل مع كل أنواع هذه الفايروسات وذلك لاشتراكها بنفس المحددات المستضدية كذلك تفشل المصول أحادية النسيلة في الكشف عن السلالة الفايروسية التي لا تحتوي على المحدد المستضدي الموجود في السلالة المتخصصة عليها.
5. طريقة إنتاج المصل المضاد متعدد النسيلة
يحضر بحقن حيوان لبون بالمحلول الفايروسي النقي الحاوي على جسيمات الفايروس النقية المذابة في المحلول الملحي الفسيولوجي (0,85% كلوريد الصوديوم) وغير المختلطة مع أية شوائب نباتية والخالي من أيونات الفوسفات أو البوريت لأنها مؤذية للحيوان وأكثر الحيوانات استعمالا في التمنيع هي الأرانب وخاصة الأرنب الأوربي Olyclolagus cuniculusلسهولة تربيته، وأن أفضل عمر لتلقيحه بين 3-6 أشهر إلا أن الأضداد التي ينتجها هي سريعة الترسب في الاختبارات المصلية وتستعمل أيضا الجرذان البيضاء وخنازير غينيا والماعز في إنتاج المصول المضادة كما تستعمل الخيول لإنتاج المصل المضادة لفايروسات البطاطا ولكنها صعبة الترسيب في الاختبارات المصلية.
يتم إنتاج المصل بحقن الأرنب بجرعة مقدارها مللتر واحد من المحلول الفايروسي إما بالحقن العضلي Intramuscular injection في عضلة الفخذ أو بالحقن الوريدي Intravenously injection في وريد الأذن أو تحت الجلد Hypodermic injection وأحيانا في العقد اللمفية ونادرا في خف القدم، ويفضل عند إجراء الحقن العضلي للأرنب أن يخلط المحلول الفايروسي بكمية مساوية له حجما من مادة فرند المساعدة الكاملة" Complete Freunds adjuvant المكونة من البارافين المعدني Mineral paraffin بنسبة 85% مع %15 من مركب "المانيد أحادي الأوليت" Mannide monooleate مع 0,05 % من معلق بكتريا Mycobacterium المقتولة والمجففة، ويمكن استعمال مادة "فرند المساعدة الناقصة" Incomplete Freunds adjuvant والتي تنقصها البكتريا حيث تعمل هذه المادة سواء كانت كاملة أو ناقصة على تحسين القدرة الإمناعية للحيوان بسبب إعاقتها لتقدم الفايروس في الدم مما يعطي الفرصة للجهاز المناعي للتعرف الأفضل على الفايروس وبالتالي إنتاج أضداد أكثر تخصصا. يفضل عند تمنيع الحيوان أن يعطى أولا حقنة وريدية تعقبها حقنة عضلية بعد أسبوع ثم حقنة عضلية ثانية بعد ثلاثة أسابيع من الثانية حيث تسبب الحقنة الأولى "الاستجابة الأولية" Primary response وتظهر أولا في الدم الأضداد من النوع IgM والتي ليس لها دور في التفاعلات المصلية مع الفايروسات وذلك بعد حوالي أسبوع من الحقن ثم ينخفض تركيزها فيه تدريجيا ويحل محلها في الدم الأضداد المطلوبة وهي من النوع IgG والتي يزداد تركيزها فيه بعد الحقنة العضلية الأولى ثم يرتفع التركيز كثيرا بعد الحقنة العضلية الثانية التي تعرف بالحقنة التعزيزية Booster injection والتي تسبب ظهور "الاستجابة المناعية الثانوية" في الحيوان Secondary or Hyperimmune response. تؤثر طريقة الحقن على تركيز الأضداد في الدم حيث تصل إلى تركيزها الأعلى بعد أسبوعين تقريبا في الحقن الوريدي وبعد 4-8 أسابيع في الحقن العضلي أو تحت الجلد. إن أفضل الأضداد تخصصية هي المستحصلة من الدم بعد الحقنة التعزيزية بمدة أسبوعين تقريبا أما إذا أعطي الحيوان حقنات أخرى لاحقة فقد يسبب ذلك إنتاج أضداد أقل تخصصية. طورت تقانة لإنتاج المصول المضادة من دون الحاجة لحقن الحيوان بالفايروس الكامل ولكن ببروتين الغطاء الفايروسي فقط والمحضر في خلايا بكترية معدلة وراثيا لإنتاج هذا البروتين والذي ينقى ويمنع به الحيوان وتتوفر الأن تجاريا مستحضرات للعديد من بروتينات الأغطية الفايروسية المعدة لإنتاج المصول المضادة للفايروسات ومنها فايروس الاصفرار التماوتي للباقلاء(FBNYV).
طريقة الحصول على المصل المضاد من الأرنب وخزنه
يتم الحصول على دم الحيوان الممنع بعد حوالي أسبوعين من الحقنة التعزيزية وذلك بسحب بحدود 20 مل من الدم من وريد الأذن بواسطة الإبرة أو بعمل قطع حاد عمودي بشفرة معقمة فيه ثم جمع الدم في بيكر معقم وتركه دون تحريك عند درجة حرارة المختبر لمدة نصف ساعة ليتجلط الدم ثم تزال الخثرة الدموية الحاوية على الفايبرين وكريات الدم الحمراء بواسطة ملقط وترمى ثم يعرض مصل الدم المتبقي والحاوي على الأضداد إلى انتباذ واطئ بسرعة 5000 دورة / دقيقة لمدة 10 دقائق ويؤخذ الرائق والذي يمثل المصل المضاد المحضر ويوضع في قناني معقمة ومعتمة محكمة القفل وتخزن عند 4م أو بطريقة التجفيد Lyophilization مع إضافة أزايد الصوديوم أو الكليسيرول بتركيز نهائي في المصل المضاد وهو 0,02 و 50 % على التوالي لمنع حصول أية نموات فطرية أو بكتيرية تلوث المصل.
6. طريقة إنتاج المصل المضاد وحيد النسيلة
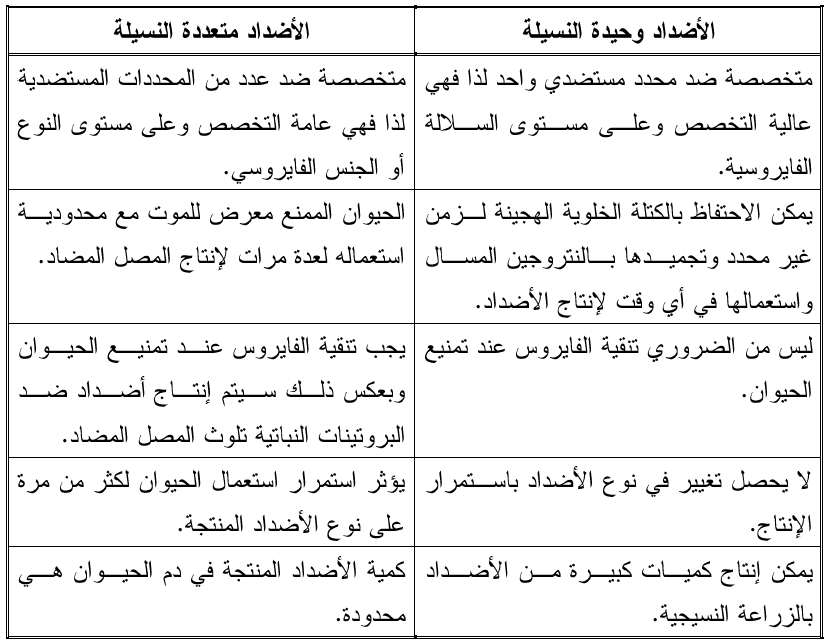
تعد طريقة إنتاجه من التقانات المصلية الرائدة التي أتاحت الفرصة لإنتاج مصول عالية التخصص وإلى مستوى السلالات الفايروسية باستعمال الزراعة النسيجية الحيوانية لخلايا معينة لفأر التجارب الأبيض والاستغناء عن استعمال الحيوان الحي في الإنتاج وبالتالي تميزت هذه المصول بمزايا تفوقت بها على المصل المضاد متعدد النسيلة، (الجدول 1) ويتم إنتاج هذه المصول بتمنيع الفأر أولا بالفايروس المطلوب ثم يخدر الحيوان ويشرح للحصول على خلايا الطحال والتي تمتاز بقدرتها على إنتاج الأضداد من النوع IgG وكذلك على خلايا "المايلوما غير الإفرازية" Non-Secretory myeloma Cells وهي الخلايا التي تمتاز بقدرتها على التكاثر ثم يتم دمج الخليتين للحصول على الخلية الهجينةHybrid Cell والتي تسمى أيضا الكتلة الخلوية الهجينة Hybridomas وهي تحمل صفات الخليتين الأصليتين بعد ذلك تزرع الخلايا الهجينة في وسط زرعي سائل خاص يسمى RPM1 وباستعمال طبق الزراعة النسيجية البلاستيكي المكون من 96 حفرة وبواقع خلية هجينة واحدة في كل حفرة حيث تبدأ بالتكاثر وإنتاج الأضداد وحيدة النسيلة لأنها ناتجة من خلية واحدة والتي تجمع من كل حفرة أي أن كل كتلة خلوية هجينة متكاثرة في كل حفرة ستنتج نوعا من الأضداد وحيدة النسيلة المتخصصة على محدد مستضدي معين، ويبين الشكل (3) مخططا لطريقة إنتاج الأضداد وحيدة النسيلة.
الجدول (1): مقارنة بين الاضداد وحيدة ومتعددة النسيلة
سلبيات الأضداد وحيدة النسيلة
رغم تخصصها العالي وقدرتها على تشخيص السلالات الفايروسية إلا أنها تحمل السلبيات التالية (1) يحتاج تحضيرها وعزلها إلى عمل مختبري تخصصي مكثف مع زمن طويل وهذا يفرض كلف مادية باهظة مقارنة بكلف إنتاج الأضداد متعددة النسيلة (2) إن صفة التخصصية العالية قد لا تكون مرغوبة أحيانا لأنها تسبب عدم الكشف عن السلالات غير المتخصصة عليها، كذلك فان هذا التخصص العالي يجعلها غير قادرة على تحسس التغيرات الشكلية Conformational Changes التي قد تحصل في الغطاء البروتيني الفايروسي وخاصة في اختبار الإليزا بسبب ارتباطه مع الطبق أو لأسباب أخرى.

الشكل (3): مخطط لطريقة إنتاج المصل وحيد النسيلة بالزراعة النسيجية للخلايا الهجينة المتكونة من خلايا الطحال والمايلوما غير الإفرازية للفأر الممانع.
الشكل مقتبس من Cann (2005).
7. مؤشر التمايز المصلي
مؤشر التمايز المصلي SDI و Serological differentiation indeX هو مقياس للتفاعل المصلي المتبادل Serological Cross reactivity لفايروسين مختلفين مع مصل مضاد معين يتفاعلان معه ولكن بكفاءة متفاوتة حيث تكون كفاءة التفاعل عالية مع الفايروس الأساسي الذي تم تمنيع الحيوان به لإنتاج ذلك المصل فيما تكون منخفضة مع الفايروس الثاني المتفاعل الذي لم يتم تمنيع الحيوان به ويعبر عن هذا المؤشر برقم يساوي ضعفي درجة تخفيف تفصل بين "التخفيف المتجانس" Homologous titer وهي درجة تخفيف المصل المضاد عند تفاعله مع الفايروس الأساسي وبين "التخفيف المتغاير" Heterologous titer وهي درجة تخفيف المصل المضاد عند تفاعله مع الفايروس الثاني الذي لم يتم تمنيع الحيوان به ويستفاد من هذا المؤشر لبيان درجة القرابة المصلية والتي تعبر عن القرابة التصنيفية بين الفايروسين حيث أنه كلما كانت قيمة هذا المؤشر عالية كلما دل ذلك على بعد العلاقة بين الفايروسين، ولتحقيق الدقة في قياس هذا المؤشر وبسبب التباين في استجابة الحيوان للتمنيع عليه فان قيمته لا تكون موثوقة إلا إذا اعتمدت على معدل عدة قراءات له، وهو يقاس بعدة تقانات مصلية منها الإليزا والانتشار المناعي في الاكار.
8. أهم الطرق المصلية المستعملة في تشخيص فايروسات النبات
1. الطرق الترسيبية
تعد الطرق الترسيبية Precipitation methods إحدى أهم الطرق المصلية التقليدية لتشخيص فايروسات النبات والتي تعتمد الرؤية المباشرة البصرية الناتج التفاعل بين الضد والفايروس وهي طرق متوسطة الكفاءة فقد تراجع استعمالها منذ ثمانينات القرن العشرين بعد تطوير التقانات الحديثة وخاصة الأليزا. يفضل قبل إجراء تفاعلات الترسيب اختيار أفضل حالة تفاعل بين تخافيف الفايروس والمصل المضاد والتي يطلق عليها "نسبة التناسب المثلى" Optimal proportion ratio حيث يتم مزج سلسلة من تخافيف الفايروس مع سلسلة من تخافيف المصل المضاد للحصول على أفضل حالة تفاعل بين تخفيفين معينين لهما واعتمادهما في التجارب اللاحقة لتجنب الهدر في كمية المصل المضاد المستعملة وأيضا لعدم حصول التفاعل وفشله بسبب زيادة تخفيف أحدهما عن الحد الذي لا يحقق التفاعل.
وفيما يلي وصفا للطرق الترسيبية المستعملة في التشخيص
أ- طريقة الترسيب في وسط سائل
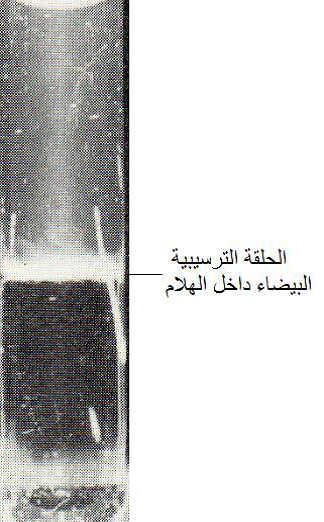
تعد طريقة الترسيب في وسط سائل Precipitation in liquid medium والتي يطلق عليها أيضا "الاختبار الحلقي" Ring test من الاختبارات السريعة والرخيصة التكاليف وسهلة التنفيذ ولكنها تستهلك كمية كبيرة من المصل المضاد كما أنها قليلة الحساسية.
تنجز هذه الطريقة بوضع كمية من المصل المضاد في أنبوبة زجاجية صغيرة ويضاف إليها عصير النبات المصاب فتنتشر جزيئات الضد في العصير تدريجيا وبالمقابل تنتشر جسيمات الفايروس في محلول المصل المضاد وفي موقع معين في منطقة تداخل المحلولين يتكون راسب أبيض بشكل منطقة كثيفة معلقة في موقع معين في الأنبوبة ويرى بالعين بوضوح، (الشكل 4).

الشكل (4): اختبار الترسيب الحلقي في الأنابيب (أ) نتيجة الاختبار متمثلة بالحلقة الترسيبية البيضاء المتكونة بين عصير النبات المصاب ومحلول المصل المضاد (ب) مخطط للفاعل المصلي بين المتفاعلين.
ب - طرق التلازن
طرق التلازن Agglutination methods هي طرق ترسيبية طورت لزيادة حساسية طرق الترسيب التقليدية وذلك بادمصاص جسيمات الفايروس على جزيئات معينة أكبر حجما منها وهي الكلوروبلاستيدات النباتية وتستعمل أيضا جزيئات اللاتكس Latex أو خلايا الدم الحمراء لبعض الحيوانات اللبونة وبذلك أمكن زيادة حساسية الكشف عن الفايروسات مقارنة بالطرق الترسيبية التقليدية بمقدار 100 ضعف تقريبا، وفيما يأتي وصف لأهم طرق التلازن المستعملة:
1- طريقة تلازن الكلوروبلاستيدات
تعد طريقة تلازن الكلور وبلاستيدات Chloroplast agglutination method وتسمى أيضا "طريقة التلازن على الشريحة الزجاجية" Agglutination method On Slide من الطرق البسيطة التي تجرى باستعمال الشريحة الزجاجية المستعملة للفحص بالمجهر الضوئي وتستعمل بمحدودية مع الفايروسات الثابتة خاصة والتي تمتاز بجسيماتها العصوية وبتراكيزها العالية في النبات وتنفذ الطريقة بوضع قطرة من العصير الخام لورقة النبات المصاب الطازجة على الشريحة الزجاجية وتمزج مع قطرة مماثلة حجما من المصل المضاد فيظهر خلال نصف ساعة تقريبا تكتل تلازني بسبب ارتباط جسيمات الفايروس المدمصة على الكلوربلاستات الخلوية مع جزيئات الضد وتكوين معقد يظهر بوضوح يمكن ملاحظته بالعين أو الاستعانة بمجهر بسيط (الشكل 5) فيما لا يظهر التلازن إن كان النبات مصابا بنوع فايروسي آخر أو إن لم تكن الإصابة فايروسية، كما تعد هذه الطريقة من طرق الكشف الحقلي السريع عن الفايروسات.

الشكل (5): اختبار تلازن الكلوروبلاستيدات. حيث تظهر قطرة عصير النبات المصاب بالفايروس الممزوجة مع المصل المضاد المتخصص على شريحة مجهر زجاجية، ويبدو التفاعل التلازني المظهر واضحا.
2- طريقة اللاتكس التلازنية
تنفذ طريقة اللاتكس التلازنية Latex agglutination method بربط جسيمات الفايروس بحبيبات اللاتكس البلاستيكية المجهرية الكروية المنتظمة والتي تمتلك صفة ادمصاص البروتين وهي متوفرة تجاريا بأحجام مختلفة ويؤدي هذا الارتباط إلى زيادة كفاءة التلازن وبالتالي تحسين الكشف عن الفايروسات الموجودة بتركيز منخفض جدا في النبات واستعملت هذه الطريقة بنجاح للكشف عن فايروسات البطاطا والبقوليات لغاية التركيز 0.1 - 0.5 ميكرو غرام فايروس / مل عصير نباتي.
3- طريقة التلازن الفايروبكتيري
تعد طريقة التلازن الفايروبكتيري من طرق التلازن المطورة والحساسة للكشف عن فايروسات النبات الموجودة بتركيز منخفض في أنسجة نباتاتها العائلة هي طريقة تلازنية مطورة تستعمل فيها البكتريا Staphylococcus aureus وذلك لوجود البروتين A في جدارها والذي له ألفة عالية جدا للارتباط مع جزيئات الضد IgG المتخصص على الفايروس المعني، وبذلك ستصبح جسيمة الفايروس عامل الربط بين الخلايا البكتيرية فتتكون شبكة تلازنية مكونة من الأطراف الثلاثة تترسب في المحلول ويمكن مشاهدتها بسهولة وكما مبين في الشكل (6).
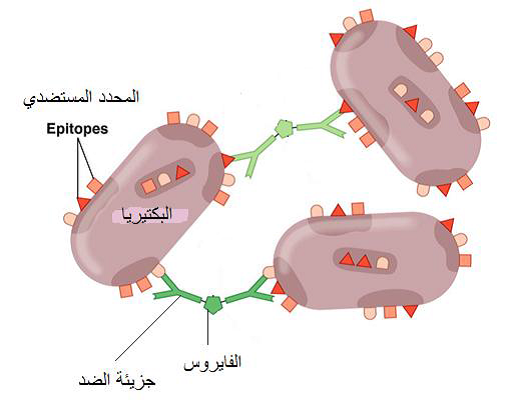
الشكل (6): اختبار التلازن الفايروبكتيري. ارتباط جزيئتي الضد مع خليتين بكتيريتين بواسطة جسيمة الفايروس.
4- طريقة التلازن الدموي السلبي الرجعي
طريقة التلازن الدموي السلبي الرجعيReverse passive haemagglutination من الطرق المصلية قليلة الاستعمال والتي تنفذ بربط جزيئات الضد مع خلايا الدم الحمراء والتي تؤخذ عادة من الأغنام ثم يضاف الفايروس المراد تشخيصه إليها فتدمص جسيماته على هذا المعقد الذي يطفو بشكل كتلة تلازنية واضحة للعين في منطقة ما فوق قعر أنبوبة الاختبار أما إن لم يكن الفايروس موجودا فتترسب خلايا الدم الحمراء في قعر الأنبوبة، استعملت هذه الطريقة للكشف عن فايروس موزائيك التبغ (TMV) وكانت بنفس حساسية اختبار الاليزا وهو أبسط تنفيذا إذ يتم بخطوات بسيطة وتؤخذ نتائجه خلال 90 دقيقة كما أن خلايا الدم الحمراء يمكن تخزينها لفترات زمنية طويلة.
ج- طرق الانتشار المناعي في الهلام
إن طرق الانتشار المناعي في الهلام Immunodiffusion in gel methods هي إحدى أهم طرق الترسيب المصلية التقليدية لتشخيص فايروسات النبات والتي تمتاز (1) تتيح إمكانية فصل السلالات والأنواع الفايروسية في الإصابات الخليطة في النبات الواحد وذلك اعتمادا على اختلاف سريع انتشارها في الهلام (2) تتيح فرصة المقارنة المباشرة بين نوعين فايروسيين مختلفين (3) احتياجاتها من المصل المضاد قليلة مقارنة بطرق الترسيب الأخرى وهي أعلى حساسية منها في الكشف عن الفايروسات، تضم هذه الطرق نوعين رئيسيين هما:
1- طريقة الانتشار المفرد في الاكار
طريقة الانتشار المفرد في الاكار Agar Single diffusion method أو طريقة الانتشار الحلقي Ring interface method والتي تسمى أيضا "طريقة أودن" Audin method نسبة إلى مبتكرها الذي أطلقها في بداية ستينات القرن العشرين هي أول طريقة ترسيب مناعية تعتمد الهلام كوسط للتفاعل حيث يخلط عصير النبات المصاب المنقى جزئيا مع هلام الاكاروز قبل تصلبه في أنبوبة اختبار زجاجية صغيرة ثم يضاف المصل المضاد إلى الهلام بعد تصلبه فتنتشر جزيئاته في ثقوب الهلام الدقيقة وتتكون حلقة ترسيبية بيضاء اللون في موقع واضح في الهلام نتيجة تفاعلهما بسبب انتشار احد المتفاعلين وهو المصل المضاد في الهلام باتجاه واحد فيما يكون المتفاعل الثاني وهو العصير النباتي ثابتا في الهلام، يمكن إجراء الطريقة بالية معاكسة حيث يمزج المصل المضاد مع الهلام ثم يضاف عصير النبات المصاب، (الشكل 7).
الشكل (7): طريقة الانتشار المفرد في الاكار لفايروس الموزائيك الأصفر للشلغم (TYMV) حيث تحوي الطبقة العليا من الأنبوبة على المحلول الفايروسي فيما تحوي الطبقة السفلى على المصل المضاد وتلاحظ الحزمة الترسيبية عند حدود الطبقتين.
الشكل مقتبس من Gibbs وHarrison ((1980.
2- طريقة الانتشار المزدوج في الاكار
طريقة الانتشار المزدوج في الاكار Agar double diffusion method والتي تسمى أيضا "طريقة أكترلوني" Ouchterlony method نسبة إلى مبتكرها الذي أطلقها في ستينات القرن العشرين هي تطوير للطريقة السابقة حيث تنفذ في طبق بتري بلاستيكي أو زجاجي مغطى قعره بغشاء رقيق جدا من مادة الفورمفار Formvar البلاستيكية، حيث يصب الهلام في الطبق وبعد تصلبه يتم عمل حفرة مركزية واربعة محيطية عادة وبمسافات منتظمة فيه ويوضع في الحفرة المركزية المصل المضاد وفي المحيطية عصير النبات المصاب المنقى جزئيا، وبذلك ستنتشر جزيئات الضد وجسيمات الفايروس كل منهما باتجاه الأخرى قطريا داخل الهلام وستتكون عند منطقة التقائهما أهلة ترسيبية بيضاء اللون تحيط عادة بحفرة العينة والتي تمثل المعقد الترسيبي المتكون من جزيئات الضد وجسيمات الفايروس وتستمر الأهلة باصطياد المزيد منهما خلال حركتهما باتجاهه مما يزيد من وضوح الهلال الترسيبي تدريجيا بتقدم وقت الاختبار ولغاية 24 ساعة. إن شكل وتقاطع الأهلة الترسيبية المتكونة يعطيان دليلا على وجود أكثر من سلالة أو نوع فايروسي في إصابة خليطة في النبات المختبر وكما مبين في الشكل (8). جرى تطوير لهذه الطريقة بتعليم الجسيمات الفايروسية أو جزيئات الضد شعاعيا لتصبح نشطة إشعاعيا Radioactive حيث يسهل ذلك كثيرا من رؤية الأهلة بواسطة التصوير الشعاعي Radioautography. تعتمد حركة الفايروسات في الهلام على شكل الفايروس وحجمه فالفايروسات البلورية هي الأكفأ انتشارا في ثقوبه لصغر حجمها أما الفايروسات العصوية والباسيلية فانتشارها بطئ أو مستحيلا أحيانا بسبب طولها الكبير نسبيا مما يجعلها تنحشر في ثقوب الاكار، ولغرض تجاوز هذه المشكلة تتم المعاملة بمادة تكسر الجسيمات الفايروسية ليسهل مرورها ومن أكثر المواد استعمالا هي المواد المنظفة Detergents وخاصة مركب كبريتات دوديسيل الصوديوم" SDS Sulphate , Sodium dodecyl والتي تمزج مع الاكار أو مع عصير النبات المصاب، كما يمكن تكسير الجسيمات الفايروسية بواسطة الموجات فوق الصوتية Sonication. أجري تطوير لهذا الاختبار باستبدال الاكاروز بمادة هلامية سكرية مستخرجة من البكتريا Pseudomonas elodea وأدى ذلك إلى تحسين كفاءة الطريقة وزيادة حساسيتها في الكشف عن الفايروسات بمقدار 100 ضعف مقارنة بالطريقة التقليدية باستعمال الاكاروز والتي تتحسس وجود الفايروس في العينة لغاية 910 جسيمة/مل عصير نباتي وبذلك أصبحت الطريقة المطورة مكافئة لطريقة الاليزا.

الشكل (8): الأهلة الترسيبية البيضاء اللون المتكونة حول حفر العينات المصابة والتي تدل علي وجود الفايروس.
الشكل مقتبس من Gibbs و Harrison (1981).
3- طرق الترحيل الكهربائي المناعي في الهلام
تعد طرق الترحيل الكهربائي المناعي في الهلام Immunoelectrophoresis in gel تطويرا لطرق الانتشار المناعي في الهلام حيث يعرض الهلام إلى جهد كهربائي ضعيف باستعمال تقانة الترحيل الكهربائي Electrophoresis للمساعدة في تسريع حركة الجسيمات الفايروسية وجزيئات الضد في الهلام المغمور في محلول منظم مناسب، وينفذ ذلك عمليا بعدة إجراءات منها وضع المصل المضاد في خندق Trough يعمل في الهلام موازيا لمسار حركة الجسيمات الفايروسية وبذلك سيتكون هلالا ترسيبيا موازيا للخندق وأمام حفر العينات (الشكل 9) طورت هذه الطرق اعتمادا على خاصيتين تمتازان بها جسيمات الفايروس والضد lgG وهما (1) إمكانية حركتهما الكهربية في الهلام Electrophoretic mobility بسبب الشحنات التي على أسطحهما (2) وجود التخصصية المستضدية Antigenic Specificity بينهما فيما تعتمد طرق الانتشار المناعي التقليدية على الخاصية الثانية فقط، كما جرى تطوير آخر لهذه الطرق بابتكار طريقة "الترحيل الكهربائي المناعي الصاروخي" Rocket Immunoelectrophoresis حيث يمزج الاكاروز مع كمية مناسبة من المصل المضاد وبذلك يمثل المتفاعل الثابت فيما يضاف المحلول الفايروسي على سطح الهلام بعد تصلبه ليمثل المتفاعل المتحرك ثم يعرض الهلام إلى الجهد الكهربائي وبذلك ستتحرك الجسيمات الفايروسية باتجاه قطب الانود بسبب شحنتها السالبة ويأخذ شكل انتشارها في الاكاروز شكل لهب الصاروخ المنطلق و تتناسب مساحة هذا الشكل طرديا مع تركيز الفايروس في محلوله، وقد أدى هذا التطوير إلى إمكانية الكشف عن كميات قليلة جدا من فايروس موزائيك القرنابيط (CaMV) ولغاية التركيز 25 نانوغرام (ng) /مل.

الشكل (9): اختبار الترحيل الكهربائي المناعي في الأكار لفايروس تبرقش الباقلاء (BBMV) حيث تظهر الحزمة الترسيبية المتموجة في الهلام الممزوج مع المصل المضاد محيطة بحفر العينات والتي ظهرت نتيجة تفاعل المصل المضاد مع جسيمات الفايروس التي تحركت في الهلام بتأثير الجهد الكهربائي.
الشكل مقتبس من Gibbs و Harrison (1980).
2. الطرق المناعية الإشعاعية
الطرق المناعية الإشعاعية Radioimmune methods هي طرق قليلة الاستعمال وتعتمد على الكشف عن الفايروسات مباشرة في النبات الحي أو خارج النسيج الحي حيث تعلم جزيئات الضد شعاعيا بإحدى النظائر المشعة ومنها نظير التريتيوم Tritium ونظير اليود المشع 125I الذي يرتبط مع الحامض الاميني "التايروسين" الموجود في الكابسيد الفايروسي ويتم حقنها في النبات المصاب فتنتشر في أنسجته وترتبط مع الفايروس ثم يؤخذ العصير النباتي ويفحص شعاعيا ويتم الكشف عن الفايروس، وقد استعملت هذه الطريقة في الكشف عن فايروس موزائيك التبغ (TMV) وفايروسات أخرى في تجارب الزراعة النسيجية وخاصة زراعة البروتوبلاست وكذلك للكشف عن الفايروسات في أنسجة ناقلاتها الحشرية، ولكن من سلبيات هذه الطريقة هي عدم ضمان وصول الأضداد المعلمة شعاعيا إلى الخلايا النباتية المصابة ثم إلى الجسيمات الفايروسية. أما في اختبارات الكشف عن الفايروسات خارج النسيج النباتي فانه يتم إضافة الأضداد المعلمة شعاعيا إلى أنابيب انتباذ نبيذة بلاستيكية Disposable tubes فتدمص علي سطحها الداخلي ثم يضاف الفايروس الذي سيرتبط مع جزيئات الضد المتخصصة المشععة وبالتالي يسهل ملاحظة ذلك الارتباط بسهولة بالتصوير الشعاعي.
3. طرق الاليزا
الاليزا Elisa هو مصطلح مشتقة كلماته من الأحرف الأولى للطريقة المصلية "اختبار المناعة الامتصاصية المرتبطة بالإنزيم "Enzyme Linked Immunosorbent Assay التي ابتكرها Clark و Adams ((1977 والتي أحدثت ثورة في تشخيص الفايروسات عموما ومنها الفايروسات النباتية، فهي طريقة عالية الكفاءة في الكشف عن الفايروسات بسبب حساسيتها العالية اذ يمكنها الكشف عن تراكيز منخفضة جدا للفايروس تصل الى 1-10 نانوغرام / مل عصير نباتي كما أنها سهلة التطبيق واقتصادية وتتيح إمكانية فحص عدد كبير من العينات في وقت واحد وهي تعتمد في الكشف عن الفايروسات على إحداث تغيير لوني بسبب التفاعل المصلي بين الفايروس والأضداد المرتبطة بإنزيم الفوسفاتيز الذي يغير لون المادة الأساس التي يعمل عليها فيظهر اللون الأصفر الذي يدل على وجود الفايروس في العينة المختبرة، توجد عدة طرق من الاليزا حيث جرى تطوير على الطريقة التقليدية وهي طريقة الأليزا المباشرة وفيما يأتي وصف لهذه الطرق.
أ- طريقة الاليزا المباشرة
طريقة الاليزا المباشرة Direct Double Antibody Sandwich-ELISA وتسمى اختصارا DAS-ELISA هي الطريقة الأساسية التي ابتكرها Clark و Adams ( (1977ويستعمل فيها طبق من البوليسترين Polystyrene microtiter plate المكون من 96 حفرة والذي يمتاز بخاصيته في ادمصاص البروتين حيث يمثل الطبق الطور الصلب من التفاعل Solid phase فيما تكون بقية مواد التفاعل سائلة، يلخص الشكل (10) خطوات هذه الطريقة.

الشكل (10): طريقة الاليزا المباشرة DAS- Elisa
يبين الشكل الخطوات الأربع الأساسية للطريقة والتي تتكرر في كل حفرة في طبق البوليسترين المكون من 96 حفرة وكما يأتي: الخطوة (1) إضافة محلول الضد lgG إلى الحفرة لترتبط جزيئاته بقعرها ثم تغسل الحفرة. الخطوة (2) إضافة العينة (عصير النبات المصاب) فترتبط جسيمة الفايروس مع جزيئة الضد ثم تغسل الحفرة. الخطوة (3) إضافة محلول المترابط Conjugate وهو عبارة عن جزيئة الضد IgG والمرتبط من نهايته الثابتة (FC) مع إنزيم الفوسفاتيز القاعدي Alkaline phosphatase، ويكرر غسل الحفرة. الخطوة (4) إضافة المادة الأساس عديمة اللون إلى الحفر وهي مركب فوسفات البارانايتروفينيل" P-mitrophenyl phosphate التي رمز لها بالكرات البيضاء، حيث سيعمل عليها الأنزيم ويحولها إلى اللون الأصفر (الكرات السوداء) بسبب سحب الفوسفات منها ويشاهد هذا اللون بصريا وظهوره دليل وجود الفايروس أو يقرأ امتصاصه طيفيا عند الطول الموجي 405 نانوميتر.
الشكل مقتبس منCann (2005).
ب- طريقة الاليزا الثلاثية
طريقة الاليزا الثلاثية Triple antibody Sandwich-ELISA والتي تعرف اختصارا TAS-ELISA كما تسمى أيضا الاليزا غير المباشرة Indirect ELISA هي تطوير للطريقة السابقة باستعمال "المترابط" Conjugate المكون من الإنزيم المرتبط مع جلوبيولين الماعز المضاد للأضداد المنتجة في الأرانب Goat antirabbit globulin حيث يحقن الماعز بالجزء الثابت (FC) الأضداد الأرانب ثم تربط أضداد الماعز مع الإنزيم لتكوين "المترابط"، وبذلك أضيفت خطوة لاختبار الاليزا المباشرة وهي ارتباط المترابط مع ضد الأرنب وليس مع الفايروس كما في الاليزا المباشرة ولذلك سميت بالطريقة غير المباشرة، (الشكل 11) تكشف هذه الطريقة عن مدى واسع من سلالات النوع الفايروسي المراد تشخيصه باستعمال نفس المصل المضاد وذلك بسبب قدرة التفاعل المصلي لأضداد الأرنب مع عدد واسع من "المترابطات"، وعليه فان هذه الطريقة تجاوزت مشكلة عدم القدرة على الكشف عن السلالات غير المتخصص عليها الإنزيم في اختبار الاليزا المباشرة لذا فهي الطريقة الأصلح للكشف عن الفايروسات المتقاربة مصليا باستعمال أطباق البوليسترين غير مغلفة مسبقا بالأضداد Unpre-coated plates لان هذا الإجراء سيلغي احتمال التداخل غير المرغوب فيه مع عصير النبات الخام المصاب إذا ما استعملت أطباق غير مغلفة. ورغم ذلك تبقى طريقة الاليزا المباشرة هي الأفضل في الكشف الروتيني عن فايروسات النبات في الحالات التي لا تظهر فيها مشكلة تخصصية السلالة أو التركيز المنخفض جدا للفايروس في النسيج النباتي. يمكن استبدال إنزيم الفوسفاتيز القاعدي بإنزيم Horseradish peroxidase إلا أن هذا الأخير لا يفضل استعماله مع عصير جذور النباتات العشبية لاحتوائها على مركبات تتفاعل مع هذا الانزيم مما يربك النتائج.

الشكل (11): طريقة الاليزا الثلاثية TAS-ELISA. تنجز الطريقة وفق الخطوات التالية: (1) إضافة محلول الضد IgG المنتج في الأرنب إلى الحفرة لتدمص جزيئاته بقعرها (2) إضافة الفايروس (3) إضافة ثانية لمحلول الضد IgG المنتج في الأرنب إلى الحفرة لترتبط جزيئاته مع الفايروس (4) إضافة المترابط وهو محلول أضداد الماعز المنتجة ضد أضداد الارنب المرتبطة بالانزيم Enzyme labeled goat anti rabbit IgG)) (5) إضافة المادة الأساس.
الشكل مقتبس من Anon ( (1994.
ج- طريقة البنيسيلينيز- إليزا
طريقة البنيسيلينيز – إليزا Penicillinase-ELISA هي تطوير لطريقة الاليزا الثلاثية حيث استبدل إنزيم الفوسفاتيز القاعدي بإنزيم البنيسيلينيز في "المترابط" وذلك لرخص ثمنه وكفاءته في إنتاج اللون حيث يعمل هذا الإنزيم على المادة الأساس المتكونة من مادتيBromothymol blue , BTB , Bromocresol purple , BCP بنفسجيا مزرقا أو أصفرا غامقا بعد تفاعلها مع الإنزيم.
د - طريقة الاليزا التضخمية
طريقة الاليزا التضخمية Amplification-ELISA هي طريقة مطورة لطريقة الاليزا المباشرة لزيادة حساسيتها في الكشف عن الفايروسات عند وجودها بتركيز منخفض جدا في النباتات لا تتحسسه الطريق المباشرة وذلك بالسماح أولا لجزيئة إنزيم الفوسفاتيز القاعدي أولا في البدء بدورة تفاعلات تسلسلية قادرة على إنتاج 100 -1000 ضعف من النتاج اللوني البنفسجي أي زيادة الكثافة اللونية التفاعلية، (الشكل 12) ولكن من سلبيات هذه الطريقة هي أنها باهظة التكاليف بسبب ارتفاع ثمن المركبات المستعملة.
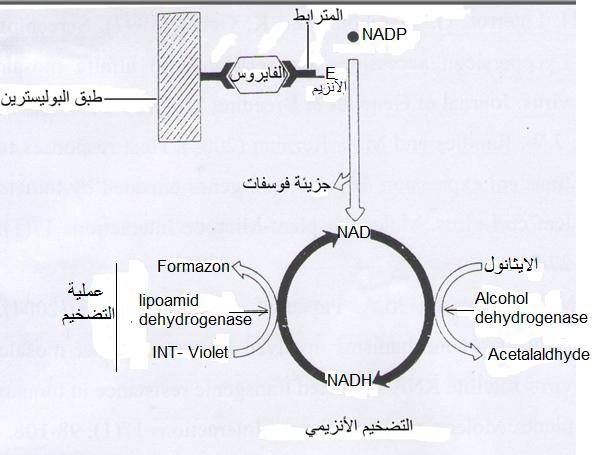
الشكل (12): مخطط طريقة الاليزا التضخمية. يبدأ إنزيم الفوسفاتيز القاعدي بدورة تفاعلية بتحويل المركب NADP إلى المركب NAD الذي يختزل الايثانول إلى مركب الأسيتيل الديهايد (الجزء الأيمن من الدورة التفاعلية) مما يؤدي إلى تحويل المركب البنفسجي INT - Violet إلى مركب الفورمازون البنفسجي اللون (الجزء الأيسر من الدورة التفاعلية).
الشكل مقتبس من Van den Heuvel و Peters (1989).
ه- الاليزا البقعية النسيجية (البصمة المناعية)
الاليزا البقعية النسيجية Dot – ELISAأو البصمة المناعية Immunoblot والتي تسمى أيضا طريقة الربط المناعي البصمي البقعي" Dot blot immunobinding هي مجموعة تقانات تمثل تطوير الطرق الاليزا باستبدال طبق البوليسترين بأشرطة النايتروسيليلوز Nitrocellulose membrane الذي يعرف اختصارا NCM أو النايلون Nylon membrane حيث يمتلك الشريط نفس خاصية الطبق وهي ادمصاص البروتينات وقد أدى هذا الاستبدال إلى تسهيل طريقة الفحص وجعلها أكثر ملائمة للكشف الحقلي الواسع المدى عن الفايروسات، تتم الطريقة بادمصاص الفايروس مباشرة على الشريط وذلك ببصم السطح النباتي المصاب المقطوع حديثا على الشريط ثم معاملته بمحلول الأضداد الأولية المتخصصة Virus Specific antibodies ثم إضافة المترابط الإنزيمي المكون من الإنزيم المرتبط مع الأضداد الثانوية يعقب ذلك إضافة المادة الأساس التي يتغير لونها وتسبب ظهور مساحات لونية بنفسجية مزرقة على الشريط في حالة وجود الفايروس. تضم الاليزا البقعية ثلاثة أنواع رئيسية هي:
1- طريقة بصمة النسيج المناعية Tissue blot immunoassay (TBIA)
يتم في هذه الطريقة بصم شريط النايتروسيليلوز مباشرة بالفايروس وذلك بعمل قطع حاد في سيقان البادرات أو أعناق الأوراق أو الأوراق المصابة وبصم الجزء المقطوع على الشريط الذي يمتص جزء من العصير النباتي الحامل للفايروس، ثم يعامل الشريط بالمحلول المنظم الغالق البروتيني Protein blocking Solution والذي يحضر من الحليب المقشود المزال الدهن منه والمحتوي على بروتين الكازين أو البومين مصل دم الثيران Bovine Serum albumin وبتركيز 1% لكليهما ثم يغمر الشريط في محلول الأضداد الأولية ثم في حلول "المترابط" المكون من الأضداد الثانوية المرتبطة بإنزيم الفوسفاتيز القاعدي، علما بأن الأضداد الثانوية هي جلوبيولينات الماعز المضادة الأضداد الأرانب Goat antirabbit immunoglobuline وتضاف أخيرا المادة الأساس وهي خليط من مركبي Nitro-tetrazolium و Bromo-Cloro-inolyl phosphate وبذلك سيظهر اللون بشكل حزم أرجوانية – بنفسجية، (الشكلين 13 و 14).
تمتاز هذه الطريقة بعدة مزايا هي (1) سهلت الكشف الحقلي عن الفايروسات حيث يمكن بصم الأشرطة مباشرة في الحقل وجلبها إلى المختبر لمعاملتها من دون الحاجة إلى جلب العينات كذلك فإن الأشرطة هي سهلة الحمل وتتحمل الخزن لمدة سنة تقريبا من البصم من دون التأثير على كفاءته التشخيصية وبذلك يمكن للباحث إجراء التشخيص في إي وقت يرتئيه خلال هذه المدة (2) توفر معلومات عن طبيعة توزيع الفايروسات في الأنسجة النباتية المختبرة وذلك من خلال طبيعة توزيع اللون على الشريط (3) إن عصر الجزء النباتي المصاب للحصول على العصير كما في الطرق المصلية الأخرى يعطي الفرصة لتخفيف الفايروس بسبب عدم وجوده في الأنسجة الخالية منه لذا فإن هذه الطريقة تجاوزت هذه السلبية لأنها تدمص الفايروس مباشرة من النبات كما تبين تماما موقع وجود الفايروس في النبات وفي أي نسيج تحديدا (4) هي طريقة للكشف عن الفايروسات إذ لا يستغرق إجرائها أكثر من ثلاث ساعات ويمكنها الكشف عن الفايروسات لغاية التركيز 1-5 بيكو غرام (Pg)/مل عصير نباتي. جرى تطوير لهذه الطريقة من قبل HSU سنة 1984 باستعماله للأضداد الثانوية المحضرة في الماعز والمعلمة بالذهب والتي يطلق عليها Gold-labeled goat antirabbit IgG وذلك لزيادة حساسيتها حيث يظهر التفاعل بلون وردي.
2- طريقة البصم البقعي Dot-Blot Assay
تسمى أيضا طريقة الربط المناعي البصمي البقعي Dot-Blot Immunobinding وهي تماثل طريقة بصمة النسيج المناعية TBIA إذ يستعمل فيها أيضا شريط النايتروسيليلوز أو ورق الطباعة العادي Plain paper إلا أن طريقة البصم هي التي تختلف عن الطريقة السابقة حيث يبصم الشريط بعصير النبات المصاب بحقنه بشكل بقع منتظمة صغيرة عليه بواسطة الة "المشعب" Manifold المرتبط بجهاز تفريغ بسيط، حيث يوضع الشريط داخل المشعب الذي يضخ العصير في مواقع محددة على الشريط وبكميات ثابتة لكل بقعة والتي تتراوح بين 25-100 ميكروليتر بعدها يخضع الشريط لنفس إجراءات طريقة بصمة النسيج المناعية حيث تظهر النتائج بشكل بقع لونية بنفسجية تشاهد بسهولة بصريا أو باستعمال جهاز قياس الكثافة الانعكاسي Reflectance densitometer، تعد هذه الطريقة سريعة وبسيطة وحساسة جدا في الكشف عن الفايروسات حيث أن مدة الكشف لا تتجاوز ثلاث ساعات وهي أكثر حساسية مع بعض الفايروسات من طريقة الاليزا المباشرة، كما جرى تطوير لطريقة تنفيذها وذلك بإجراء البصم الكهربائي للشريط Electroblotting بدل الضخ بتأثير عملية التفريغ.

الشكل (13): عملية بصم شريط النايتروسيليلوز بالورقة النباتية المصابة بعد طيها وقطعها وتبدوا نتائج الكشف بظهور اللون البنفسجي للبصمات (الشكل الأسفل) وهذا دليل وجود الفايروس.
3- طريقة البصمة الغربية Western Blot
هي طريقة جمعت بين البصمة البقعية والترحيل الكهربائي حيث يتم أولا دنتـرة الجسيمات الفايروسية بعد أخذ العصير من النبات وغليه مع محلول "الترس" المنظم Tris buffer وهو المركب Tris-hydroxymethyl-aminoethane hydrochloride مضافا إليه مادة التنظيف SDS لغرض تفكيك جسيمات الفايروس لتسهيل مرور الجسيمات في الهلام، مع إضافة الميركا بتوايثانول 2-mercaptoethanol كمادة مانعة للتأكسد مع الجليسيرين ثم يعرض المزيج إلى الترحيل الكهربائي وتمرر الجسيمات في هلام "البولي اكريل أمايد" Polyacrylamide الممزوج مع SDS فتنفصل وحدات الكابسيد وفقا لوزنها الجزيئي وتقارن مع معلمات جزيئية" Molecular markers معلومة الوزن الجزيئي وكذلك مع بروتين العصير النباتي السليم ثم ينقل الهلام بعد انتهاء الفصل الكهربائي ويوضع فوق صحيفة شريط النايتروسيليلوز أو تستعمل أغشية من مادة PVDF المماثل له بالمساحة تماما وبذلك يتم بصم الشريط كهربائيا Electroblotting بحزم البروتينات الموجودة في الهلام، ثم يعامل الشريط بالطريقة ذاتها التي يعامل بها في طريقة بصمة النسيج المناعية وتظهر النتائج بشكل بصمات لحزم البروتينات الفايروسية، تستعمل هذه الطريقة أساسا لدراسة خصائص البروتينات الفايروسية وتقدير أوزانها الجزيئية والكشف عنها في النباتات المصابة والمعدلة وراثيا ولكنها أقل استعمالا في تشخيص الفايروسات كذلك فهي غير مناسبة للتعامل مع أعداد كبيرة من العينات.
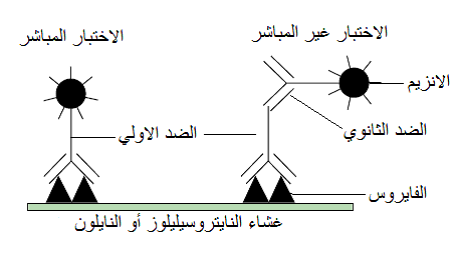
الشكل (14): مخطط يبين مبدأ طريقتي البصم المناعي والبصمة الغربية حيث يتم في الاولى وكما مبين في الجزء الايمن من الشكل تثبيت الفايروس على غشاء النايتروسيليلوز ببصم الغشاء مباشرة بالعصير النباتي الحاوي على الفايروس، أما في طريقة البصمة الغربية فانه يتم تثبيت الفايروس على غشاء النايتروسيليلوز أو النايلون بعد فصله كهربائيا بطريقة الترحيل الكهربائي أولا ثم وربطه بالغشاء ثم يتم الكشف عنه بذات آلية عمل اختبار بصمة النسيج المناعية وبالطريقتين المباشرة وغير المباشرة.
الشكل مقتبس من Cann (2005).
و- طرق الاليزا المحورة
جرت تحويرات أخرى كبيرة على الاليزا التقليدية حيث دمجت مع طرق أخرى والغاية هي زيادة كفاءة الكشف عن الفايروسات، وضمت الطرق المحورة الأتية:
1- طريقة البايوتين – أفيدين Biotin - Avidin method
تعتمد هذه الطريقة على الألفة العالية جدا بين بروتين الأفيدين ومركب البايوتين حيث يرتبط الأخير كيميائيا مع الأضداد من الطرف الثابت للضد (FC) وبذلك لا يؤثر على القدرة الارتباطية للأضداد مع الجسيمات الفايروسية أما الأفيدين فيرتبط مع الإنزيم وبذلك سيكون "المترابط" المحور بدل المترابط التقليدي المستعمل في طرق الاليزا، عليه سيتم في هذه الطريقة ارتباط الضد مع الجسيمة الفايروسية من الجهة المتغايرة للضد ومع البايوتين من الطرف الثابت للضد وسيرتبط الأفيدين مع البايوتين بحكم الألفة العالية جدا بينهما وقد أدى هذا التحوير إلى زيادة حساسية الكشف عن السلالات أو الأنماط المصلية الفايروسية Serotypes والتي تعجز عنها طرق الاليزا العادية.
2- الاليزا بالمادة الأساس المفلورة Flurogenic substrate ELISA
طورت هذه الطريقة من قبل Torrance و Jones سنة 1982 لزيادة حساسية الاليزا المباشرة باستعمال مادة أساس مفلورة يعمل عليها إنزيم الفوسفاتيز القاعدي وهي 4-methyl umbellifery phosphate وقراءة النتائج باستعمال جهاز المطياف، ثم أضاف Reichenbacher سنة 1984 تطويرا آخر والذي أطلق عليه "الاليزا فائقة الدقة " Ultramicro ELISA باستعمال المادة الأساس أعلاه وباستعمال أطباق خاصة بحجم 10 ميكروليتر لكل حفرة.
3- الاليزا المحورة باستعمال قطعة الضد 2(F(ab
طورت هذه الطريقة من قبل Barbara و Clark سنة 1982 لتحسين الاليزا غير المباشرة حيث يتم اصطياد الفايروس بواسطة جزء مفصول من الضد IgG وهي القطعة 2(F(ab والتي تمثل المنطقتين الثابتة والمتغايرة للسلسلة الخفيفة للضد (الشكل 1) والتي ترتبط مع جسيمة الفايروس المرتبطة بحفر طبق الاليزا ثم يضاف "المترابط " المكون من الإنزيم المرتبط مع البروتين A ذو القدرة الارتباطية مع القطعة 2(F(ab، وبذلك أدى هذا التحسين إلى الاقتصاد في استعمال الضد والاستغناء عنه في تحضير المترابط، استعملت هذه الطريقة بكفاءة في تشخيص فيروسات أشجار الفاكهة صغيرة الثمار.
4- الاليزا المناعية الشعاعية Radioimmune ELISA
طورت من قبل Ghabrial و Sheperd سنة 1980 لزيادة كفاءة وحساسية الاليزا المباشرة حيث استبدل المترابط التقليدي (الإنزيم المرتبط بالضد) بمترابط مشعع وذلك بتعليم الضد باليود المشع 125I مما سهل الكشف عن الفايروسات.
5- الاليزا على حبيبات البوليسترين ELISA on polystyrene beads
استعملت حبيبات البوليسترين بقطر 6,5 ملم بدل طبق الاليزا البلاستيكي وبواقع حبيبة واحدة لكل اختبار حيث ثبت كفاءة هذا التحوير في الكشف عن بعض أنواع الفايروسات مقارنة بالاليزا التقليدية ومنها فايروس موزائيك فول الصويا (SMV).
4. طرق الفلورة المناعية (الصف المناعي)
تستعمل طرق الفلورة المناعية (اللصف المناعي) Immunofluorescence methods للكشف المباشر عن الفايروسات داخل نسيج النبات الحي وتنفذ بأخذ سلخة من نسيج النبات المصاب وتثبيتها على الشريحة الزجاجية المستعملة للفحص بالمجهر الضوئي وإضافة محلول جزيئات الضد المعلمة بصبغة مفلورة Fluorescent dye والتي ترتبط بجسيمات الفايروس وبالتالي يمكن تحسسها في النسيج النباتي بسهولة باستعمال مجهر لاصف (فلورسنتي) اعتمادا على الضوء الصادر من المادة المفلورة وأكثر الصبغات المفلورة استعمالا هي صبغة Fluorescienisothiocyanate او صبغة Tetramethylrhodamineisothiocyanate اذ تعطي الصبغة الأولى ضوءا أخضرا مصفرا فيما تعطي الثانية ضوءا أحمرا برتقاليا. جرى تطوير لهذه الطريقة بابتكار الطريقة غير المباشرة والتي يتم فيها تعليم الأضداد الثانوية بالصبغة المفلورة ويقصد بالأضداد الثانوية هي الأضداد المحضرة ضد جزيئات الضد IgG والتي ترتبط بالأضداد الأولية غير المعلمة. من الضروري استعمال أنسجة سليمة للمقارنة وذلك لاحتمال حصول الفلورة غير المتخصصة أو تسمى "الفلورة الذاتية" Autofluorescence مما يربك النتائج لذا فان استعمال المحلول الغالق وهو مصل دم الثيران Bovine Serum albumin قد يكون مفيدا في منع التفاعلات غير المتخصصة وغير المرغوب فيها، كما تعد هذه الطريقة مفيدة في الكشف عن الفايروسات في نواقلها الحشرية. عملية الصف (الفلورة) فيزيائيا هي إطلاق الضوء من قبل الجسم المتفلور بسبب امتصاصه للضوء الصادر من مصدر ضوئي معين ثم إطلاق جزء من ذلك الضوء وهي صفة تمتلكها العديد من الجزيئات الحيوية الخلوية حيث أن قاعدة الكوانين ومشتقاتها تطلق ضوءا أزرقا بنفسجيا عند تعريضها للأشعة فوق البنفسجية عند أس هيدروجيني منخفض مما يسهل تشخيصها في الاختبارات الكروماتوغرافية، وتمتص الأحماض النووية الصبغات المفلورة مثل صبغة "الأكريدين البرتقالية" Acridine orange وبذلك يسهل تحديد مواقع الأحماض النووية داخل الخلايا باستعمال المجهر الضوئي وأن الأحماض النووية مفردة الخيط هي الأكثر امتصاصا لهذه الصبغة وتعطي ضوءا ناريا أحمر فيما تعطي الأحماض النووية مزدوجة الخيط ضوءا أخضرا مصفرا. إن هذه الصبغات هي صعبة الدخول في الأنسجة النباتية سميكة الجدران لذلك يعامل النسيج النباتي بإنزيمات تحليل البروتينات ومنها إنزيم Pronase أو يعامل بأنواع من الإنزيمات المحللة للأحماض النووية وذلك لتسهيل دخول الصبغة. يطلق مصطلح " العنصر ألاستشفافي" Tracer على أية مادة متفلورة أو مشعة إذا استعملت لمتابعة جسيمة معينة داخل النسيج النباتي أو خارجه بسبب ما تصدره من ضوء ولذا يطلق على الأضداد المرتبطة بصبغة مفلورة مصطلح "الأضداد الاستشفافية" Antibody tracer والتي تستعمل لتحسين الطرق المصلية وخاصة في طريقة الانتشار المزدوج في الأكار.



|
|
|
|
دراسة يابانية لتقليل مخاطر أمراض المواليد منخفضي الوزن
|
|
|
|
|
|
|
اكتشاف أكبر مرجان في العالم قبالة سواحل جزر سليمان
|
|
|
|
|
|
|
المجمع العلمي ينظّم ندوة حوارية حول مفهوم العولمة الرقمية في بابل
|
|
|