


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
Read More
Date: 21-12-2015
Date: 12-7-2016
Date: 29-7-2018
|
Self-Ionization of Water and the pH Scale
The observation that pure water has low levels of H+ and OH− is easily understood by the Brønsted–Lowry theory. In this self-ionization behavior, one molecule of water acts as the proton donor (acid) and a second molecule acts as the proton acceptor (base) to generate hydroxide and a hydronium ion (H3O+).
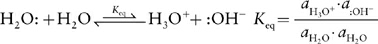
As noted in the equation above, thermodynamic equilibrium constants (Keq) are formally defined by the activities (ai) of each species. However, for dilute solutions where the solvent is in vast excess, the activity of the solvent (water in this case) is unity (aH2O = 1) and the activities for the dilute ions are essentially equal to their molar concentrations (aH3O+ ~ [H3O+], aOH− ~ [:OH−]). As a result, the equilibrium dissociation constant for the self-ionization reaction of water (its acid dissociation constant) is simplified to
Kw = [H3O+][: OH−]
At 25°C, Kw = 10−14 M2, and since the self-ionization reaction yields equal amounts of H3O+ and OH−, both are present at 10−7 M in pure water. As other acids or bases are dissolved in and react with water, the concentrations of H3O+ and OH− re-equilibrate such that their product always equals 10−14. Thus when [H3O+] = 1 M, [OH−] = 10−14 M and vice versa. To simplify discussions of the relative acidity of aqueous solutions, we use the pH scale, where
pH = – log10[H3O+]
For pure water with [H3O+] = 10−7 M, the pH = 7, which is also referred to as neutral pH because the concentrations of H3O+ and OH− ions are equal. Acidic solutions have higher concentrations of H3O+ ([H3O+] > [OH−]) and pH values < 7, whereas basic solutions have lower concentrations of H3O+ ([H3O+] < [OH−]) and pH values > 7.


|
|
|
|
إدارة الغذاء والدواء الأميركية تقرّ عقارا جديدا للألزهايمر
|
|
|
|
|
|
|
شراء وقود الطائرات المستدام.. "الدفع" من جيب المسافر
|
|
|
|
|
|
|
العتبة العبّاسيّة: البحوث الّتي نوقشت في أسبوع الإمامة استطاعت أن تثري المشهد الثّقافي
|
|
|