


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 16-4-2017
التاريخ: 25-1-2016
التاريخ: 18-7-2017
التاريخ: 24-1-2017
|
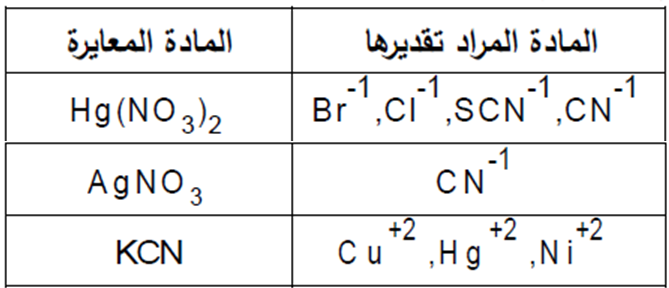
الطرق المستخدمة في معایرات الترسیب:
یمكن تقسم طرق معایرات الترسیب تبعاً لنوع العامل المرسب
1 القیاسي الفضي(المعایرات الفضیة)
2 القیاسي الزئبقي (المعایرات الزئبقیة).
3 القیاسي السیانیدي (المعایرات السیانیدیة).
وهناك معایرات أخرى مثل معایرة الكبریتات مع كلورید الباریوم و الجدول یوضح بعض تطبیقات طرق معایرات الترسیب و العوامل المرسبة والمواد المراد تقدیرها بهذه العوامل. و تتم معایرة المادة المراد تحلیلها في هذه الطرق بواسطة محلول قیاسي ككاشف ومرسب وهذه الطرق لها عدة شروط أهمها:
1 أن یكون الترسیب سریعا .
2 أن یكون الراسب غیر قابل للذوبان في وسط الترسیب.
3 ألاتتأثر النتائج بعملیة الامتزاز التي یمكن أن تحدث.
4 أن یكون هناك دلیل مناسب للكشف عن نقطة النهایة.

وهى المعایرات التي یستخدم فیها محلول قیاسي من نترات الفضة AgNO3 كعامل ترسیب ، وتستخدم هذه الطرق لمعایرة الهالیدات(كلور، بروم، یود) ، واشباه الهالیدات (السیانید ، والكبریتید، والثایوسیانات) ویمكن أیضا تعیین الفضة في محالیلها باستعمال محلول قیاسي من كلورید الصودیوم أو البوتاسیوم، وتنقسم معایرات الفضة الى قسمین:
1. معیرات مباشرة.
2. معایرات غیر مباشرة.
ویتم في النوع الأول معایرة محلول الهالید مباشراً مع محلول نترات الفضة القیاسي حتى الوصول إلي نقطة النهایة.
أما النوع الثاني فیتم بإضافة زیادة من محلول نترات الفضة القیاسي تم یتم معایرة الزیادة من نترات الفضة القیاسي بواسطة محلول قیاسي من (ثایوسیانات البوتاسیوم أو ثایوسیانات ألامونیوم).
2.القیاسي الزئبقي:
وهذه الطریقة تمثل المعایرات التي یستعمل فیها محلول نترات أو بیركلورات الزئبقیك وذلك لأن هذه الأملاح تامة التأین عكس أملاح الزئبقیك الأخرى ، ویمكن استخدام محلول الزئبقیك القیاسي في تقدیر الكلوریدات والبرومیدات والثایوسیانات التي تكون رواسب من كلوریدات وبرومیدات وثایوسیانات الزئبقیك وهي أملاح ضعیفة التأین ، وعند استعمال هذه طریقة لتقدیر كمیات قلیلة من الكلوریدات في وسط حامضي یستخدم محلول نیتروبروسیدالصودیوم [Na2(CN)5NO] كدلیل لأنه یكون مع أیون الزئبقیك ملحا قلیل الذوبان في الماء وهذا بدوره یسبب عكارة للمحلول عند نقطة نهایة التفاعل،أما في حالة الثایوسیانات فیستعمل شب الحدیدیك كدلیل ونقطة نهایة التفاعل هي النقطة التي یختفي فیها لون ثایوسیانات الحدیدیك
الأحمر من المحلول كما في المعادلات الاتیة:

كما تستعمل طریقة القیاسي الزئبقي لتقدیر الیودات بمعایرتها مع محلول الزئبقیك القیاسي فیتكون أولاً مركب معقد ذائب وعند نقطة نهایة التفاعل یظهر راسب احمر هو یودید الزئبقیك الأحمر .


3.القیاسي السیانیدي:
وبهذه الطریقة یمكن تعیین محالیل السیانید باستخدام محلول قیاسي من نترات الفضة و یطلق على هذه الطریقة طریقة ( لیبج) أو طریقة التعكیر، وتعتمد هذه الطریقة على ظهورعكارة في المحلول عند نقطة النهایة حیث بعایر محلول السیانید بمحلول قیاسي من نترات الفضة وفي بدایة التسحیح یتكون راسب ابیض من سیانید الفضة سرعان ما یذوب بالرج في زیادة من السیانید لیكون مركب فضو سیانید البوتاسیوم ، وعند نقطة النهایة حیث ینفذ أیون السانید فان إضافة قطرة من نترات الفضة یسبب ظهور عكارة في المحلول عند نقطة النهایة بسبب تكون راسب فضو سیانید الفضة كما هو موضح في المعادلات الاتیة:


ومن عیوب هذه الطریقة صعوبة تعیین نقطة التعكیر بالضبط ویمكن التغلب على هذه الصعوبة بإضافة قلیل من محلول الامونیا ویودید البوتاسیوم كدلیل حیث یمنع محلول الامونیا ترسب فضو سیانید الفضة ویترسب بدلا منه یودید الفضة الأصفر للدلالة على نقطة النهایة كما توضح المعادلات الاتیة :
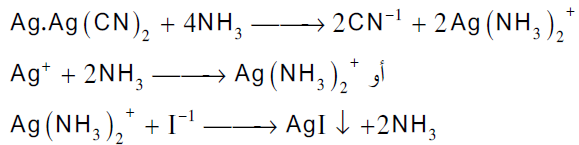
3.معایرات الكبریتات مع كلورید الباریوم
یمكن تقدر الكبریتات بتسحیحها مع ایون الباریوم وذلك باستخدام دلیل الامتزاز (الألیزارین الأحمرأوالثورین) عند pH =3.5 (وسط حمضي قوى) في خلیط من الماء والكحول ، حیث تعطى كبریات الباریوم راسباً شدید الامتزاز یبقى معلقا في المحلول ویمكن تمثیل المعایرة قبل نقطة النهایة بالمعادلة التالیة:

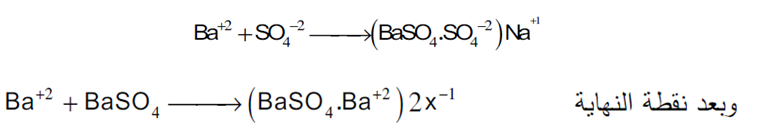
فالدلیل یحل محل( X-1 ) في المعادلة السابقة لان الدلیل یعمل عمل أیون سالب ،بدلك یمكن رؤیة نقطة النهایة بسهولة وذلك بمجرد تبدل لون المحلول من الأصفر إلي الوردي ویحدث التغیر على سطح الراسب


|
|
|
|
تفوقت في الاختبار على الجميع.. فاكهة "خارقة" في عالم التغذية
|
|
|
|
|
|
|
أمين عام أوبك: النفط الخام والغاز الطبيعي "هبة من الله"
|
|
|
|
|
|
|
قسم شؤون المعارف ينظم دورة عن آليات عمل الفهارس الفنية للموسوعات والكتب لملاكاته
|
|
|