


 الفيزياء الكلاسيكية
الفيزياء الكلاسيكية
 الكهربائية والمغناطيسية
الكهربائية والمغناطيسية
 علم البصريات
علم البصريات
 الفيزياء الحديثة
الفيزياء الحديثة
 النظرية النسبية
النظرية النسبية
 الفيزياء النووية
الفيزياء النووية
 فيزياء الحالة الصلبة
فيزياء الحالة الصلبة
 الليزر
الليزر
 علم الفلك
علم الفلك
 المجموعة الشمسية
المجموعة الشمسية
 الطاقة البديلة
الطاقة البديلة
 الفيزياء والعلوم الأخرى
الفيزياء والعلوم الأخرى
 مواضيع عامة في الفيزياء
مواضيع عامة في الفيزياء|
أقرأ أيضاً
التاريخ: 29-12-2021
التاريخ: 24-5-2016
التاريخ: 21-4-2017
التاريخ: 25-4-2017
|
الكتل النووية ؛ النظائر
لقد تم قياس كتل النوى بدقة مرتفعة باستخدام أجهزة مطياف الكتلة ، ويوضح الشكل (1) رسماً بيانياً تخطيطياً لأحد أنواع ذلك الجهاز. وفيه يسمح لأيونات العنصر ــ المطلوب دراسته ــ بالهروب من المصدر الأيوني كما هو مبين بالشكل ، ثم تعجل حزمة الأيونات عبر فرق للجهد مقداره V، ويتم تجميعها بواسطة فتحات مثل S2. تتحرك الأيونات بسرعة مقدارها v عندما تغادر S2 ثم يتم حرفها لتأخذ مساراً دائرياً بواسطة المجال المغناطيسي كما هو مبين. ويمكن قياس نصف قطر المسار r وذلك بتحديد المواقع التي تصطدم فيها الأيونات بلوح فوتوغرافي أو كاشف من أي نوع آخر.
يرتبط نصف قطر الانحناء r بكتلة الأيون بالعلاقة الآتية:
(1) 
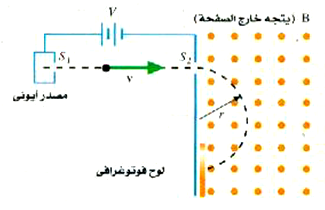
الشكل (1): يتم حرف الأيونات بواسطة مجال مغناطيسي في مطياف الكتلة.
إذا علمت قيم r ، B ، q و V لأمكن حساب كتلة الأيون، ولكي نحصل على كتلة النواة فإننا نطرح كتلة الإلكترونات المصاحبة للأيون من m.
عندما استخدم مطياف الكتلة لقياس الكتلة النووية، برزت ظاهرة مثيرة للاهتمام فكثيراً ما شوهد أن للعنصر الواحد حزمتين او اكثر من الأيونات في مطياف الكتلة بمعنى أن الجسيمات التي تصل إلى الكاشف تتخذ نصفي قطر محددين تماماً او أكثر؛ فإذا ضممنا هذا الاكتشاف لأمكننا استنتاج أن: نوى العنصر الواحد قد يكون ذا كتل مختلفة.
وسنعتبر المثال التالي على سبيل التوضيح، فعند تحليل الكلور النقي كيميائياً في مطياف الكتلة، اتضح أنه يتكون من نوعين من النوى:
النوع الاول: الكتلة = 34.97 u النسبة المئوية = 75.4
النوع الثاني: الكتلة = 36.97 u النسبة المئوية = 24.6
ويقال أن الوفرة الطبيعية للنوع الأول هي 76.4 بالمائة، وأن الوفرة الطبيعية للنوع الثاني 24.6 بالمائة. ويسلك كلا النوعين نفس السلوك الكيميائي تماماً، ومعنى ذلك أن التركيب الإلكتروني لكل منهما مطابق للآخر، ومن ثم فلابد أن شحنتيهما النوويتين متساويتان، وكل منهما تساوي العدد الذري Z مضروباً في كم الشحنة e. ويسمى مثل هذا النوى، الذي له نفس الشحنة وله كتل مختلفة نظائر العنصر المذكور.
للنوى المتناظر نفس عدد البروتونات ولكن عدد النيوترونات هو الذي يختلف.
ولكي نقسم النوى حسب الكتلة والشحنة وعدد النويات، فإن العادة جرت على تمييز العنصر الذي رمزه x بالشكل zAX. فعلى سبيل المثال، تمثل نظائر الكلور الذي تناولناه منذ قليل بالرمز 1735Cl و1737Cl حيث لكل من النظيرين نفس العدد الذري، Z =17، ولكن أحداهما عدده الكتلي A =35 أما الآخر فعدده الكتلي A = 37، ويشار إلى هذين النظيرين على أنهما الكلور 35 والكلور 37. ولنتناول مثالاً آخر وهو 92238U ويطلق عليه يورانيوم 238. الذي تحتوي نواته على شحنة مقدارها +92e وبها 92 بروتوناً و 238 – 92 = 146 نيوتروناً. اما اليورانيوم 235، 92235U فبه نفس عدد البروتونات 92 و 143 نيوتروناً فقط داخل النواة.
ولعلك معتاد على الجدول الدوري للعناصر الذي درسته في الكيمياء، حيث تجد الكتل الذرية مدونة عادة إلى جانب العناصر، وتعرف على أنها متوسط كتل النظائر الموجودة في الطبيعة. فمتوسط كتلتي نظيري الكلور، مثلاً، هو

أن هذه هي كتل النوى، مضافاً إليها كتل الإلكترونات الذرية، ومعبراً عنها بوحدة الكتل الذرية المعرفة بدلالة كتلة ذرة الكربون 612C)) :
وحدة الكتل الذرية الواحدة (u) هي بالضبط جزء من اثنى عشر جزءاً من كتلة ذرة كربون 12 واحدة 612C)).
وتنسب كل الكتل الاخرى إلى هذا المقياس العياري.



|
|
|
|
دخلت غرفة فنسيت ماذا تريد من داخلها.. خبير يفسر الحالة
|
|
|
|
|
|
|
ثورة طبية.. ابتكار أصغر جهاز لتنظيم ضربات القلب في العالم
|
|
|
|
|
|
|
العتبة العباسية المقدسة تستعد لإطلاق الحفل المركزي لتخرج طلبة الجامعات العراقية
|
|
|