


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 9-3-2018
التاريخ: 10-3-2016
التاريخ: 26-2-2016
التاريخ: 15-3-2017
|
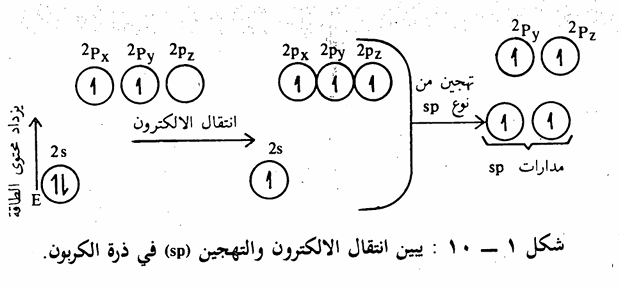
(تهجين المدارات الذرية على ذرة الكربون)
على الرغم من أن المفهوم القديم للروابط الكيميائية (صيغة لويس الالكترونية) أعطتنا فكرة عن الروابط، إلا أنها لم تناقش وضع الجزيء الفراغي (شكل الجزيء). لذلك كان لابد من توضيح الجزيء عن طريق معرفة المدارات الذرية وتهجينها والتداخل بين تلك المدارات الهجينية والذرية لتكون الروابط. يبين الترتيب الالكتروني السابق لذرة الكربون بأن الكربون له تكافؤ ثنائي. وذلك. لأنه كان إذا المدار يحتوي على الكترون، واحد فإنه بإمكانه أن يرتبط مع الكترون آخر من ذرة أخرى ويتكون بذلك رابطة كيميائية.
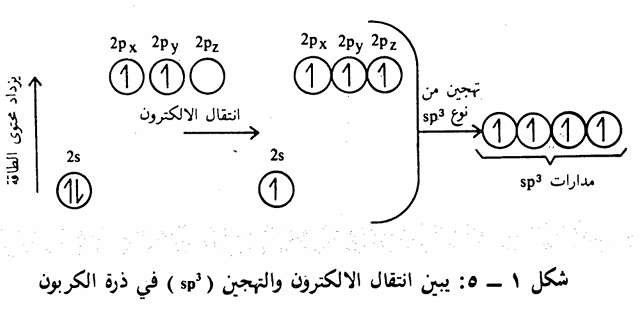
ولكن الواقع يبين أن ذرة الكربون ذات تكافؤ رباعي، أي ترتبط بأربع روابط، ولكي نفسر ذلك لابد من القول بأن احدى الكترونات المدار 25 قد ارتفع إلى المدار Pz أي تحول من الوضع الأول 1s22s22p2 إلى الوضع في حالة التهيج والاستعداد للاتحاد وهو الوضع 1s22s12p3 وبما أن المدار Pz لديه طاقة أعلى من المدار 2s فإنه يلزم طاقة لحدوث ذلك الانتقال الالكتروني، وتساوى طاقة التهيج هذه 96 كيلو سعر حراري / مول. هذا الوضع الأخير لذرة الكربون يفسر القيمة التكافؤية الرباعية للكربون إن ذرة الكربون المتهيجة لديها أربعة الكترونات منفردة (غير مزدوجة) أي يوجد أربعة تكافؤات وبالتالي بإمكانها أن ترتبط بأربعة الكترونات. من ذرات أخرى (سواء ذرات هيدروجين أو كربون أو غيرها) لكي تكون أربع روابط إلا أن هذا التفسير الأخير يبين أن هذه الروابط الأربعة غير متساوية في الطاقة. وذلك لأن مدارات 2p لديها طاقة أعلى من مدار 2s بمعنى آخر أنه يوجد نوعان من الروابط نوع يمثل الكترونات s2 والنوع الآخر يمثل الكترونات2p ولكنه من المعروف جيداً أن التكافؤات الأربعة لذرة الكربون في الهيدروكربونات المشبعة متساوية في الطاقة إذ أن القياسات التجريبية على جزئ الميثان والجزيئات العضوية
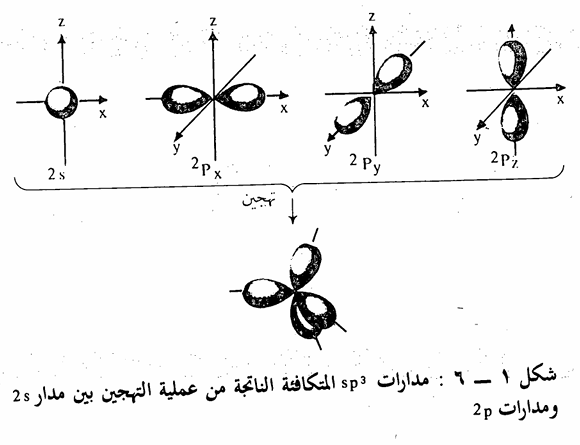
المشابهة تبين يوجد نوع واحد فقط من الروابط. فقد وجد أن أطوال وطاقة الروابط بين ذرات الهيدروجين وذرة الكربون في جزئ الميثان (أبسط جزئ عضوي)، متساوية، إذ يبلغ طول الرابطة 1٫1 أنجسترم. ويتطلب استعمال ذرة الكربون لمدارs، ومدارات p الثلاثة للترابط مع ذرات الهيدروجين أن تكون بعض. الزوايا H-C-H مساوية للزوايا بين Pxو PyوPz أي 90، في حين أنه وجد عملياً أن زوايا الروابط متساوية وتساوي زاوية هرم رباعي السطوح Tetrahedral أي 190,5وبذلك جاءت روابط الكربون والهيدروجين الأربع تشكل فيما بينها هرماً رباعي السطوح، تقع ذرات الهيدروجين على أركانه وذرة الكربون في مركزه. وهذا الترتيب يجعل التداخل يصل إلى أقصى حد ممكن وبذلك تكون الروابط أقوى ما يمكن. ولتفسير هذه الظاهرة تساوي الروابط في الطاقة وتساوي الزوايا) فإنه يمكن القول بأنه يحصل عملية تهجين Hybridization مزج أو تداخل بين مدار 2s، ومدارات 2pمشكلة أربعة مدارات هجينية متساوية في الطاقة يرمز لها بالرمز sp3 وبذلك فإنه يتكون أربع روابط متساوية في الطاقة بين ذرة الكربون وأربع ذرات هيدروجين لتكون جزئ الميثان يساهم في كل منها الكترون من مدار 1s من إحدى ذرات الهيدروجين الأربع والكترون من إحدى مدارات sp3 الأربعة للكربون. وفيما يلي شكل توضيحي يبين عملية انتقال الالكترون والتهجين في ذرة الكربون (شکل 1 - (5
الشكل 1-6 بين شكل مدارات SP3 المتكافئة الناتجة من عملية التهجين بين مدار 2s ومدارات 2p
اما الشكل 1-7 فيبين جزئ الميثان على شكل رباعي السطوح
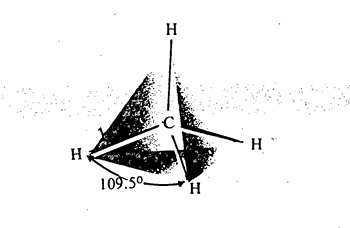
شكل 1-7 : جزيء الميثان على شكل رباعي السطوح
وتجدر الإشارة إلى أن الرابطة بين الكربون والهيدروجين تسمى رابطة سيجما يرمز لها بالحرف اليوناني ) وهي أبسط الروابط الكيميائية (سوف ندرس فيما بعد رابطة الباى
) وهي أبسط الروابط الكيميائية (سوف ندرس فيما بعد رابطة الباى  ولها شكل أسطواني متماثل حول محور الارتباط بين نواتي الذرتين وتتكون هذه الرابطة إما من ! من مدارات (s) كما في حالة تكوين جزىء الهيدروجين وإما بالكترون (s) والكترون من مدار p. وقد تتكون من الكترون من مدار (s) وآخر من مدار sp كما هو الحال في جزىء الميثان. أو من الكترونين من مداري sp3 كما هو الحال فى جزىء الايثان )الرابطة بين C-C سوف نتحدث عنها في الفصل القادم (
ولها شكل أسطواني متماثل حول محور الارتباط بين نواتي الذرتين وتتكون هذه الرابطة إما من ! من مدارات (s) كما في حالة تكوين جزىء الهيدروجين وإما بالكترون (s) والكترون من مدار p. وقد تتكون من الكترون من مدار (s) وآخر من مدار sp كما هو الحال في جزىء الميثان. أو من الكترونين من مداري sp3 كما هو الحال فى جزىء الايثان )الرابطة بين C-C سوف نتحدث عنها في الفصل القادم (
هذا وبإمكان ذرة الكربون أن تكون هجين من نوع ps,sp2 كما . حالة في الهيدروكربونات غير المشبعة )الالكينات والألكاينات على التوالي). أضف إلى ذلك أن ذرات أخرى غير الكربون يمكن أن تكون هجين sp, sp2, sp3 مثل النيتروجين في جزىء الأمونيا (NH3)، البورون في جزىء فلوريد البورون (BF3) والبريليوم في جزىء كلوريد البريليوم (BeCl2) على التوالي.
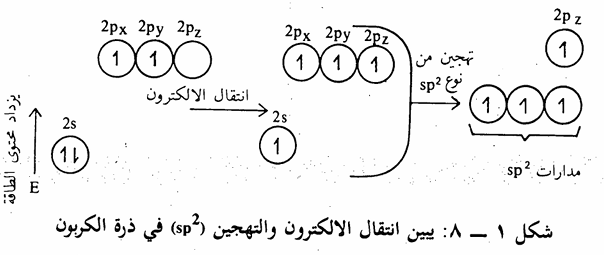
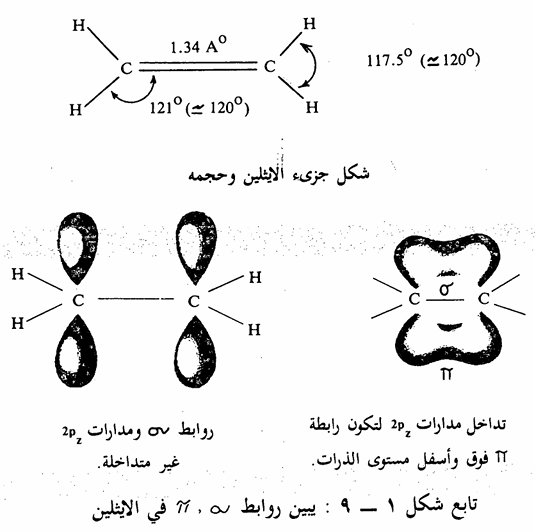
في حالة جزىء الايثيلين ethylene كمثال على الالكينات، نجد. أن ذرة الكربون ترتبط مع ثلاث ذرات أخرى. كما أن القياسات التجريبية أثبتت أن تلك الذرات تقع في مستوى واحد وأن الزوايا بين الروابط الثلاث متساوية وتبلغ في جزىء الايثيلين ه120 تقريباً. يمكن تفسير تلك الظواهر بنوع آخر من التهجين لذرة. الكربون يدعى sp2. حيث يتم تهيج ثم تهجين كما في حالة جزىء الميثان إلا أنه في هذه المرة يحصل تهجين بين مدار (25) ومدارين فقط من مدارات (2p)
(شكل 1 - 8) وينتج عن ذلك ثلاث مدارات متكافئة من p ومدار مختلف غير مهجن sp2
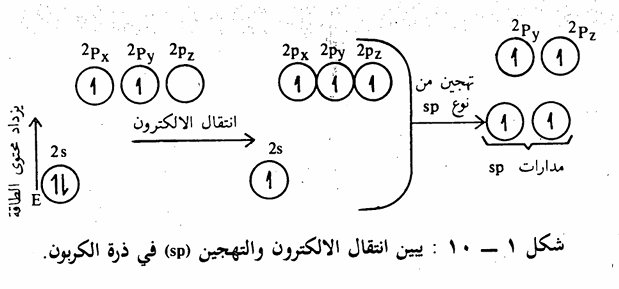
هو مدار 2pz، وهذا المدار الأخير (2pz) يعامد المستوى الذي يحوى المدارات الهجينية الثلاث (sp) التي تقع في مستوى واحد وتتوجه نحو بعضها بزاوية تساوي 120 (شکل 1 – 9).
لذلك نجد في جزىء الايثيلين والذي يتكون من ست ذرات بأن تلك الذرات تكون خمس روابط ( ) بين ذرتي الكربون، وذرتي الكربون وأربع ذرات هيدروجين. توجد تلك الروابط الخمس روابط ( في مستوى واحد. ويتداخل مداری 2 على ذرتي الكربون فيكون رابطة جديدة تسمى رابطة باي
) بين ذرتي الكربون، وذرتي الكربون وأربع ذرات هيدروجين. توجد تلك الروابط الخمس روابط ( في مستوى واحد. ويتداخل مداری 2 على ذرتي الكربون فيكون رابطة جديدة تسمى رابطة باي  bond- وهي متعامدة على مستوى روابط به الآنفة الذكر، بمعنى آخر أن روابط الباى هذه متعامدة على مستوى جزىء الايثيلين. وبذلك فإن جزىء الايثيلين يحتوى على نوعين من الروابط بين ذرتي الكربون أحدهما من النوع، والثانية من النوع. هذا وإن طاقة الرابطة ) 64 كيلو كالوري لكل مول أصغر من طاقة الرابطة (82 كيلو كالوري لكل مول ، كما تبلغ الطاقة الكلية للرابطة الثنائية (Trov) 146 كيلو كالورى لكل مول. يتضح من ذلك أن المركبات الهيدروكربونية غير المشبعة لها نشاط كيميائي أكثر من المشبعة وذلك لقدرة رابطة على التفاعل وثبات أقل بالمقارنة برابطة . وقد وجد بالقياسات أن طول الرابطة الثنائية بين ذرتي الكربون تساوي 34 1,أنجستروم، بمعنى أنها أقصر من الرابطة الأحادية (1,54 أنجستروم) بين ذرتي الكربون وهذا شيء طبيعي لأن الرابطة الثنائية لها طاقة أكبر من الرابطة الأحادية الشكل 1 - 9 يبين روابط TT ،ov في الرابطة or المضاعفة). وتجدر الإشارة إلى أن طاقة الرابطة هي الطاقة اللازمة لتكوين الرابطة (الفصل الثاني).
bond- وهي متعامدة على مستوى روابط به الآنفة الذكر، بمعنى آخر أن روابط الباى هذه متعامدة على مستوى جزىء الايثيلين. وبذلك فإن جزىء الايثيلين يحتوى على نوعين من الروابط بين ذرتي الكربون أحدهما من النوع، والثانية من النوع. هذا وإن طاقة الرابطة ) 64 كيلو كالوري لكل مول أصغر من طاقة الرابطة (82 كيلو كالوري لكل مول ، كما تبلغ الطاقة الكلية للرابطة الثنائية (Trov) 146 كيلو كالورى لكل مول. يتضح من ذلك أن المركبات الهيدروكربونية غير المشبعة لها نشاط كيميائي أكثر من المشبعة وذلك لقدرة رابطة على التفاعل وثبات أقل بالمقارنة برابطة . وقد وجد بالقياسات أن طول الرابطة الثنائية بين ذرتي الكربون تساوي 34 1,أنجستروم، بمعنى أنها أقصر من الرابطة الأحادية (1,54 أنجستروم) بين ذرتي الكربون وهذا شيء طبيعي لأن الرابطة الثنائية لها طاقة أكبر من الرابطة الأحادية الشكل 1 - 9 يبين روابط TT ،ov في الرابطة or المضاعفة). وتجدر الإشارة إلى أن طاقة الرابطة هي الطاقة اللازمة لتكوين الرابطة (الفصل الثاني).

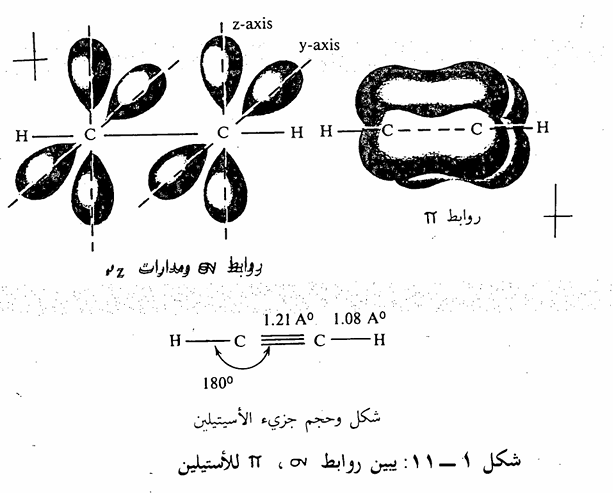
أما بالنسبة لجزيء الأسيتيلين acetylene كمثال على الالكينات)، نجد أن ذرة الكربون ترتبط مع ذرتين أحدهما ذرة هيدروجين والأخرى ذرة كربون. كما أن القياسات التجريبية أثبتت أن تلك الذرات تقع على خط واحد وأن زاوية الرابطة - - - تساوی 180 . يمكن تفسير ذلك بنوع آخر من التهجين لذرة الكربون يدعى sp. حيث يتم تهيج ثم تهجين كما في حالة جزىء الميثان إلا أنه في هذه المرة يحصل تهجين بين مدار (2s) ومدار فقط من مدارات (2p) (شکل 1 - 10) وينتج عن ذلك مدارين متكافئين من p ومدارين غير داخلة في المدارات الهجينية، هما ،2py 2p متعامدين على بعضهما البعض. لذلك نجد في جزى الأسيتيلين الذي يتكون من أربع ذرات بأن تلك الذرات تكون ثلاث روابط (α) بين ذرتي الكربون وذرتي الكربون وذرتين هيدروجين. وتقع تلك الروابط الثلاث على خط واحد ويتداخل مداري 2pz على ذرتي الكربون ليكون رابطة باي π-bond ،
كما يتداخل مداري 2pyعلى ذرتي الكربون ليكون رابطة باى أخرى وتكون تلك الرابطتين متعامدتين على بعضهما البعض. هذا وتبلغ الطاقة الكلية للرابطة الثلاثية (رابطة ، ورابطتين  ) 100 كيلو سعر لكل مول (شکل 1 – 11).
) 100 كيلو سعر لكل مول (شکل 1 – 11).



|
|
|
|
أهمية مكملات فيتامين د خلال فصل الشتاء.. 4 فوائد رئيسية
|
|
|
|
|
|
|
علماء: قرص الشمس سيبدو أكبر في عام 2025
|
|
|
|
|
|
|
جامعة الكفيل تنظّم ورشة علمية عن معايير الاعتماد البرامجي للتعليم الطبي
|
|
|