


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 27-11-2015
التاريخ: 2024-01-27
التاريخ: 18-4-2017
التاريخ: 2024-02-01
|
يعد استعمال نترات الفضة بوصفه عامل معايرة في التحليلات العيارية من أكثر العمليات الترسيبية أهمية ولهذا تسمي هذه العملية في أحيان عديدة بالتفاعلات الفضية Argentimatric Processes
وإذا أخذنا بنظر الاعتبار ما يحدث من تبدلات في التركيز الأيوني في أثناء معايرة 100سم3 من محلول NaCl .10 مع 100 سم 3من محلول AgNO3 0.1M علماً بأن ثابت إذابة كلوريد الفضة بدرجة حرارة المختبر يساوي × 10-10 1.2
بما أن التركيز الابتدائي لأيون الكلوريد -CI يساوي 0.1 مول/لتر فإن تركيز1 = PCI وكما يأتي :
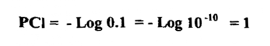
وإذا ما زدنا 50 سم3 من محلولAg 0.1M فإنها ستتفاعل مع 50 سم3 من محلول M NaCl 0.1 وهذا يعني أن 50سم3 من محلول NaCl 1.0 M قد بقيت فقط من الكلوريد في حجم كلي للمحلول قدرة 150 سم3 ولهذا فإن
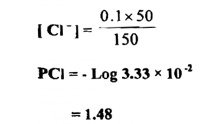
وفي حالة زيادة 90 سم3 من محلول نترات الفضة المذكور فإن ما يتبقى عندنا من كلوريد في المحلول يحسب كما يأتي :

إن هذا معناه وجود محلول مشبع من كلوريد الفضة ولا توجد زيادة من أيوناتها في المحلول عن حد الإشباع .
فإذا أردنا 100.1سم3 من محلول نترات الفضة فهذا يعني أن :

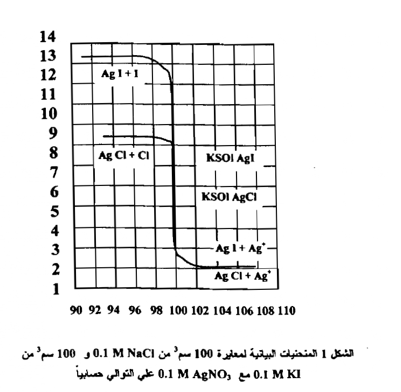
لقد وضعت القيم المحسوبة باستعمال حجوم من محلول M AgNO 0.1 إلى حد 110سم من محلول AgNO3 0.1M بهذه الطريقة في الجدول التالي والذي يمثل التبدلات في Ag بين 10% قبل و 10% بعد نقطة التكافؤ في معايرة M NaCl 0.1 و 0.1 على التوالي مقابل M AgNO3 0.1 كما أن الجدول يعطي نتائج مماثلة لقيم معايرة 100سم من محلول M KI 0.1 مقابل M AgNO3 0.1 ومن فحص نتائج قيم الأس الفضي Ion exponents بأن هناك تبدلاً حاداً من تركيز أيون الفضة بجدار نقطة التكافؤ ( بين 99.8 سم3 و 100.2 سم2 ) . وبسبب أن ثابت حاصل إذابة كلوريد الفضة أكبر بحوالي 6 10 ليوديد الفضة فإن التبدل أكثر بروزاً ليوديد الفضة مما هو عليه عند كلوريد الفضة ولهذا يوجد تبدل حاد لتركيز أيون الفضة وهو ما يبدو واضحاً . عند النظر الى المنحني العياري التالي الذي يمثل التبدلات في Ag+ Pو -PI بين 10% قبل و 10 % بعد نقطة التكافؤ في معايرة M NaCl 0.1 و 0.1 على التوالي مقابل M 0.1 AgNO3 ويمكن الحصول غالباً علي المنحني البياني نفسه باستعمال طريقة المعايرة بمقياس الجهد Potentiometrictitration باستعمال القطب الفضي Silver electrode ويمكن حساب قيم+ Ag من قيم القوة الكهربية الدافعة e.m.f وكذلك بطريقة حسابات الـpH
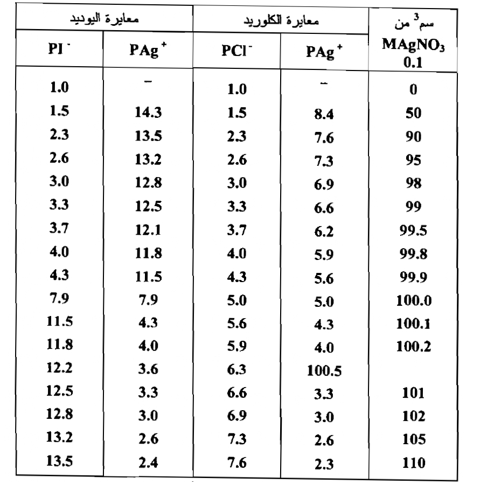
معايرة 100 سم3 من NaCl 0.1 و 100 سم3 , من KI 0.1M بالتعاقب مقابل محلول من AgNO3 M0.1 ان
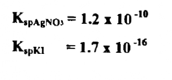



|
|
|
|
تفوقت في الاختبار على الجميع.. فاكهة "خارقة" في عالم التغذية
|
|
|
|
|
|
|
أمين عام أوبك: النفط الخام والغاز الطبيعي "هبة من الله"
|
|
|
|
|
|
|
قسم شؤون المعارف ينظم دورة عن آليات عمل الفهارس الفنية للموسوعات والكتب لملاكاته
|
|
|