


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية | تقوم محاليل الاحماض الضعيفة مع املاحها بوظيفة دارئه للباهاء (PH) |
|
|
|
أقرأ أيضاً
التاريخ: 2024-05-18
التاريخ: 2024-05-07
التاريخ: 2024-05-19
التاريخ: 16-6-2017
|
تقوم محاليل الاحماض الضعيفة مع املاحها بوظيفة دارئه للباهاء (PH)
تكتسب محاليل الاحماض الضعيفة مع أسسها الانضمامية القرينة (أو الاسس الضعيفة مع احماضها الانضمامية)، خاصية الدرء ، أي قدرة المحلول على مقاومة اي تغير في قيمة الباهاء pH عند إضافة حمض او أساس قوي بشكل أكثر فعالية مما يبديه الحجم نفسه من الماء.
ان العديد من النواتج المتوسطة للأيض مثل السكاكر المفسفرة في سبيل تحلل السكر) هي عبارة عن أحماض ضعيفة ؛ وبما أن التغيرات الطفيفة في قيم الباهاء (pH) قريبا من قيم الـ pK الخاصة بحمض ضعيف تغير في النسبة بين شكليه المتأين غير المتأين ، فإنه يجب التفاعلات داخل الخلية للتقليل من تغيرات قيم الباهاء (pH). هذا الدرء مطلوب أيضاً لأن الأيض ينجم عنه أيضاً تحرير البروتونات وقبطها (Uptake)، وفي الواقع، إن أحد المنتجات النهائية للأيض التأكسدي هو غاز ثاني أكسيد الكربون ( بلا ماء ؛ أنهيدريد ”Anhydride “ حمض الكربونيك) الذي إذا لم يدرأ سوف يؤدي إلى تحميض شديد للوسط. داخل الخلوي.
وتتضمن آليات الاستتباب التي تحافظ على قيمة باهاء (pH) السائل داخل الخلوي ما يسمى الدوارئ الفيزيولوجية ، وبشكل أساسي الفسفات والبيكربونات والبروتينات التي تتقبل بروتونات أو تطلقها فتدرأ بذلك باهاء (pH) الأوساط وتقاوم تغيرات قيمتها. وفي التجارب التي تستخدم خلاصات نسيحية أو إنزيمات منقاة ، نحافظ على قيم باهاء (pH) ثابتة بإضافة الدوارئ.
ومن الأحماض الضعيفة المستخدمة بشكل شائع كدوارئ نذكر كلا من حمض الأسيتيك (4.7 = pK) وحمض [2-N - مورفولينو] إيثان سلفونيك (أو الـ MES ، 6.1 = pK) والفسفات الثانوي من الأورثوفسفات اللاعضوية (7.2 = pK) وحمض البيبيرازين ثنائي إيثان السلفونيك ( أو الـ 6.8 = pK ،PIPES) وحمض — N هيدروكسي إيثيل بيبيرازين —2—N— إيثان السلفونيك ( أو الـ 6.8 = pK ،HEPES) وحمض ثلاثي هيدروكسي ميثيل أمينو ميثان أو التريس (8.3 = pK ،TRIS) والجليسيل جلايسين (8.2 = pK) وعند اختيار دارئة ما ، —V الأخذ بعين الاعتبار قيمة الـ pK بالنسبة إلى قيمة الباهاء (pH) المرغوبة.
كما يمكن حساب الكمية المطلوبة من الدارئة من خلال معرفتنا لعدد البروتونات المفترض أنها ستضم أو تحرر ، ومن خلال قيمة الباهاء (pH) المرغوبة نسبة إلى قيمة pK الحمض المستخدم في الدارئة ، ويجب أن نتذكر ثانية أن فعالية الدارئة تكون في حدها الأقصى عند قيم باهاء (pH) المساوية لقيمة pK أو القريبة منها.
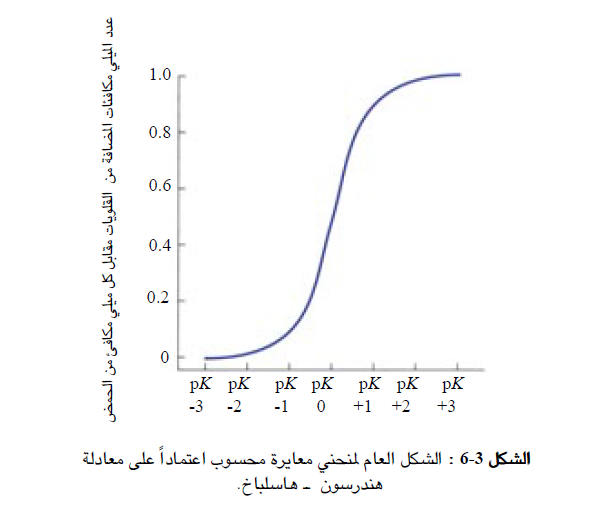
ولكن إيضاح دور الدارئة بشكل أمثل عن طريق معايرة حمض أو أساس ضعيف باستخدام مقياس الباهاء (pH) ؛ أما الطريقة البديلة ، فتقوم على حساب تغيرات قيمة باهاء (pH) المطول المدروء عندما نضيف إليه حمضا أو أساسا. وفي المثال التالي استخدمنا محلولا مدروءاً ( حمض ضعيف ، 5.0 = ^p ، مع أساسه الانضمامي) في أربع حالات لكل منها قيمة معينة للباهاء (pH) (القيم البدئية) ثم أضفنا لكل 1 مللي مكافئ (mEq) من المحلول في كل حالة 1 مللي مكافئ من KOH وقسنا تغيرات قيم الباهاء (pH) البدئية وكانت النتائج كما هو موضح في الجدول التالي :
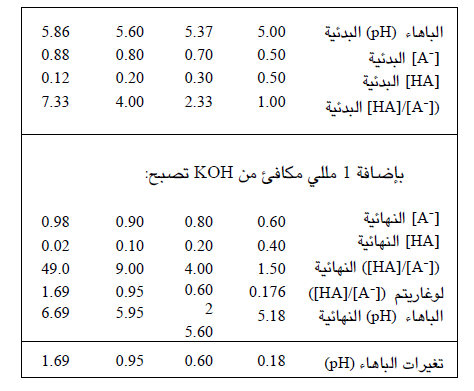
لاحظ أن مقدار تغير قيمة باهاء (pH) المطول عند إضافة مللي مكافئ واحد من أيونات الهيدروكسيل (-OH) يتعلق بشكل واضح بقيمتها البدئية ، وأنه عندما تكون قيمة الباهاء (pH) قريبة من قيمة ؛ pk، فإن المطول يقاوم حدوث تغيير في قيم الاولى بشكل أكثر فعالية، ويقال في هذه الحالة إن للمطول تأثيراً دارئا (Buffering effect). ويمكن الاستنتاج أن التأثير الدارئ لمحاليل الأحماض الضعيفة مع أسسها الانضمامية يكون على أشده عند قيم باهاء (pH) ضمن المجال ^2.0 ± p ؛ وهذا يعني أنه لدرء محلول عند باهاء (pH) قيمتها "س" يجب استخدام حمض أو أساس ضعيف قيمة الـ pk الخاصة به تساوي (( س ± 2.0)).
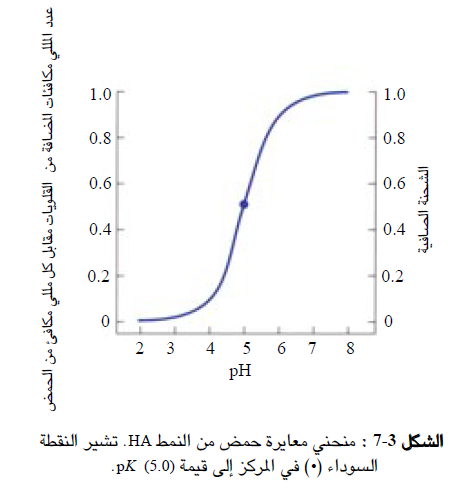
ويوضح (الشكل 3-7) علاقة الشحنة الصافية لجزيء حمضي بقيم الباهاء (pH)، ويجب الانتباه إلى أن الشحنة الجزيئية - ذات القيمة - 0.5 لا تعني أن الجزيء يحمل شحنة جزيئة ، بل تعني أن الاحتمال الإحصائي لحمل الجزيء لشحنة سالبة هو 0.5. ومن المهم أن نذكر هنا أن دراسة علاقة الشحنة التي تحملها الجزيئات الكبروية بقيمة باهاء (pH) الوسط. تشكل أساس العديد من تقنيات الفصل بما فيها استخدام الرحلان الكهربي لفصل الأحماض الامينية وبروتينات البلارما والأشكال الشادة (غير السوية) من الهيموجلوبين.



|
|
|
|
تفوقت في الاختبار على الجميع.. فاكهة "خارقة" في عالم التغذية
|
|
|
|
|
|
|
أمين عام أوبك: النفط الخام والغاز الطبيعي "هبة من الله"
|
|
|
|
|
|
|
المجمع العلمي ينظّم ندوة حوارية حول مفهوم العولمة الرقمية في بابل
|
|
|