


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 20-7-2018
التاريخ: 23-6-2016
التاريخ: 23-9-2019
التاريخ: 27-8-2019
|
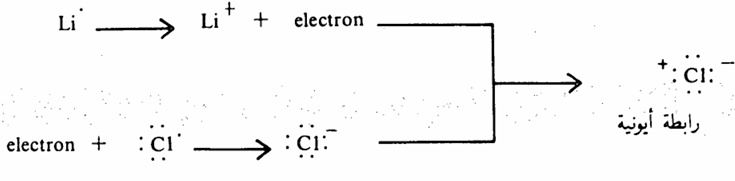
لكي نفهم تركيب الجزيئات يجب أن ندرس المفهوم القديم للروابط الكيميائية. حيث تحصل ذرة عنصر ما على الترتيب الالكتروني للغاز الخامل، الوضع الأكثر استقرارا، عن طريق دخولها في نوعين من الروابط الكيميائية، النوع الأول هو الرابطة الأيونية lonic bond. في حين أن النوع الآخر هو الرابطة التساهمية. وتتم الرابطة الأيونية بانتقال الكترون أو أكثر انتقالا كاملا من عنصر إلى عنصر آخر وبذلك: يصبح الأول أيوناً موجباً والآخر أيوناً سالباً. وتحدث تلك الرابطة بين ذرات العناصر ذات الفرق الكبير في السالبية الكهربية Electronegativity (ميل ذرة العنصر لجذب الالكترونات) وكما هو معروف فإن السالبية الكهربية تكون أكبر ما يمكن في العناصر التي تقع أعلى ويمين الجدول الدوري (عنصر الفلور وبشكل عام (الهالوجينات بينما تكون أقل ما يمكن في أسفل ويسار الجدول الدوري (عنصر البوتاسيوم وبشكل عام المعادن). لذلك نتوقع أن اتحاد المعادن والهالوجينات لتكوين الأملاح عن طريق روابط أيونية وهذا النوع من الروابط له خاصية قطبية عالية جداً (عبارة) عن أيونات موجبة وأيونات سالبة). وبشكل عام إذا كان موقع العنصر في يسار الجدول الدوري فإن ذراته تحوي الكترونات قليلة في مدار التكافؤ واحد أو اثنين)، ومثل هذه الذرة تميل لإعطاء الالكترونات إلى ذرات أخرى وتكتسب شحنة موجبة. وإذا ما اتجهنا إلى يمين الجدول الدوري فإن عدد الكترونات التكافؤ للعناصر يزداد وعليه تكون خصائص ذرات هذه العناصر هو ميلها لتقبل الالكترونات من ذرات أخرى وتكتسب شحنة سالبة (حتى نصل لتركيب الغاز الخامل وتوصف هذه العناصر بأنها عناصر تتصف بالسالبية الكهربية. وكمثال على ذلك اتحاد عنصر الليثيوم مع الكلور لتكوين كلوريد
الليثيوم.
أما الرابطة التساهمية فتحدث نتيجة للمشاركة الالكترونية المتكافئة بين الذرات كما تنص عليه قاعدة لويس Lewis عام (1916). وكمثال على ذلك اتحاد ذرتي هيدروجين لتكوين جزئ هيدروجين حيث تمثل الالكترونات بنقط أو بعلامة × وفقاً لقاعدة لويس للترتيب الالكتروني. ومن ناحية أخرى فإن ذرة الكربون لها أربعة الكترونات في مدار التكافؤ ومثلها مثل العناصر الأخرى تميل لملء مدار التكافؤ بثمانية الكترونات لكي تصل لتركيب الغاز الخامل. فمثلاً تتحد ذرة كربون مع أربع ذرات هيدروجين لتكوين الميثان أبسط مركب عضوي) وبذلك يصل كل من ذرة الكربون وذرات الهيدروجين في جزئ الميثان إلى تركيب الغاز الخامل. كما يمكن أن تحدث المشاركة المتكافئة بين ذرتي كربون أو أكثر في حالة جزىء الايثان.
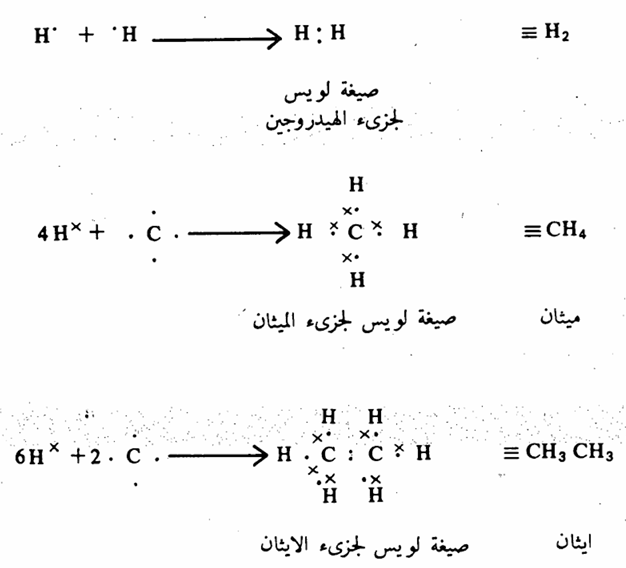
والرابطة التساهمية بين ذرتي كربون مركب الايثان هي رابطة تساهمية غير قطبية لأنها بين ذرتين من نفس النوع. وكذلك فإن الرابطة بين الكربون والهيدروجين في مركب الميثان أو مركب الايثان لا تتصف بالخاصية القطبية لأن قيمة السالبية الكهربية لكل من الهيدروجين والكربون متقاربة. أما إذا ارتبطت ذرة الكربون بعنصر آخر له ميل كبير لجذب الالكترونات مقارنة بالكربون أو الهيدروجين (أي له سالبية كهربية عالية مثل الكلور فإن الرابطة بين الكربون والكلور في هذه الحالة تكون رابطة تساهمية قطبية شحنتها السالبة جزئيا تقع على الكلور (ويرمز لها بالرمز (5) وشحنتها الموجبة جزئياً تقع على ذرة الكربون ويرمز لها بالرمز (8) كما حالة كما في كلوريد الميثل . وكذلك تكون الرابطة بين الكلور والهيدروجين في جزىء كلوريد الهيدروجين هي رابطة تساهمية قطبية.

أما في حالة مركب ميثل ليثيوم فإن الرابطة قطبية ولكن تأخذ ذرة الكربون الشحنة السالبة الجزئية (أي أن السحابة الالكترونية تتجه نحو الكربون) وذلك لأن ذرة الكربون لها سالبية كهربية أعلى من ذرة معدن الليثيوم.
كما تجدر الإشارة إلى أنه كلما زاد الفرق في السالبية الكهربية
بین الذرتين المرتبطتين كلما زادت قطبية الرابطة.
إن أكثر العناصر سالبية كهربية هي تلك الموجودة في الجزء الأيمن من الجدول الدوري. وفيما يلي ترتيب تنازلي للسالبية الكهربية للعناصر نتعامل معها أكثر من غيرها في الكيمياء العضوية.
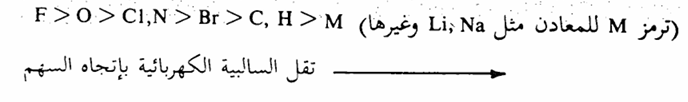
نجد أنه لمعرفة مدى قطبية الروابط أو عدمها أهمية كبيرة في معرفة الخواص الكيميائية والفيزيائية للجزيئات العضوية حيث أن قطبية الروابط يحدد مكان ونوع التفاعل على الرابطة، كما أن النشاط الكيميائي للمركبات القطبية أكثر من نظيره في المركبات غير القطبية.



|
|
|
|
التوتر والسرطان.. علماء يحذرون من "صلة خطيرة"
|
|
|
|
|
|
|
مرآة السيارة: مدى دقة عكسها للصورة الصحيحة
|
|
|
|
|
|
|
نحو شراكة وطنية متكاملة.. الأمين العام للعتبة الحسينية يبحث مع وكيل وزارة الخارجية آفاق التعاون المؤسسي
|
|
|