


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية | للمجموعات الوظيفية ذات الصفة الحمضية الضعيفة اهمية فيزيولوجية كبيرة |
|
|
|
أقرأ أيضاً
التاريخ: 2023-09-09
التاريخ: 9-7-2021
التاريخ: 5-4-2021
التاريخ: 25-1-2017
|
للمجموعات الوظيفية ذات الصفة الحمضية الضعيفة اهمية فيزيولوجية كبيرة
تملك العديد من المركبات الكيميائية الحيوية مجموعات وظيفية حمضية او قاعدية ضعيفة، وتحتوي كل البروتينات والأحماض النووية ومعظم التمائم الانزيمية والمتأيضات المتوسطة على واحدة او اكثر من هذه المجموعات (الكربوكسيلية او الامينية او تفارق الفوسفات الثانوي لاسترات الفوسفات). ولهذا السبب يعتبر السلوك التأيني (التوازنات البروتونية) للمجموعات الوظيفية الحمضية والأساسية الضعيفة أساسيا في فهم تأثير باهاء (pH) الوسط داخل الخلوي على بنية المركبات السابقة ونشاطها الكيميائي الحيوي. كما ان فهم السلوك التأيني للمجموعات السابقة سهل آليات فصل هذه المركبات وتمييزها في الابحاث والمختبرات الاكلينيكية .
نطلق على الشكل البروتوني من حمض ما (مثل HA و RNH+) باسم قاعدته الانضمامية . وبالمثل . نسمي القاعدة (الأساس) (مثل A- و RNH2) وحمضها الانضمامي (مثل Ha و RNH3) [تعني الكلمة اللاتينية : ان تجمع معا]. وفيما يلي تمثيل لأحماض ضعيفة (الأيسر) وقواعدها الانضمامية (الوسط) وقيم الــ pK الخاصة بها (الايمن) :
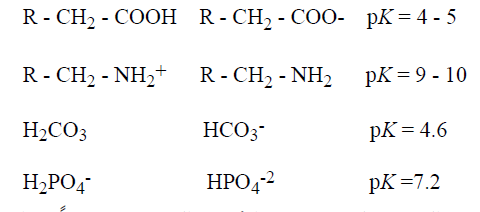
يعبر عن القوى النسبية للأحماض والأسس الضعيفة كميا بثوابت تفارقها التي تشير إلى مدى ميلها لتتأين ، وفيما يلي معادلتين تعبران عن ثابتتي تفارق (K) لصيغتين تمثيليتين لحمضين ضعيفين:
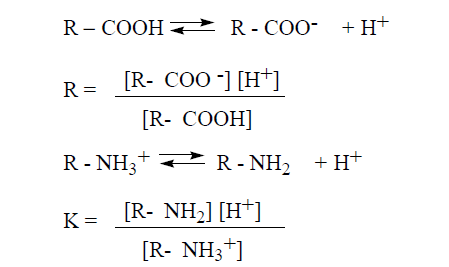
وبما ان قيم K للأحماض الضعيفة هي أرقام أسية (دليلية) وأسها (دليلها) سالب ، فإن من الأفضل التعبير عنها على شكل Pk حيث :
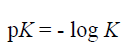
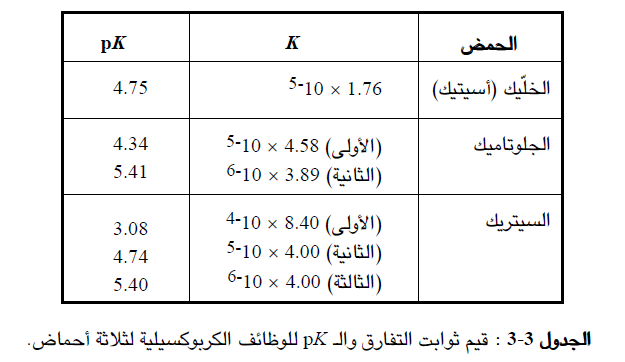
لاحظ ان Pk متعلقة بـ k كما هو الحال بالنسبة لتعلق الباهاء (pH) بتركيز ايونات الهيدروجين ، ويعرض (الجدول 3-3) قيم pk و k الخاصة بحمض أحادي وآخر ثنائي وثالث ثلاثي الوظيفة الكربوكسيلية ، ويجب ان تلاحظ ان الوظائف الحمضية الاقوى تكون لها قيم pK أقل.
ان مفهوم الحمض الضعيف يوحي ضمنا بأن قرينه أساس قوي ، وكذلك فإن قريت الأساس القوي هو حمض ضعيف. ونعبر في الكيمياء الحيوية عن القوى النسبية للأسس بقيم الــ pK لأحماضها الانضمامية (القرينة)، فعلى سبيل المثال وفيما يخص التفارق التالي :
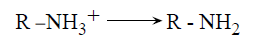
تدل pK على قيمة الباهاء (pH) التي يكون عندها تركيز الحمض (R-NH3+) والأساس (R-NH2) متساويين. ويبين استخدام متثابتة واحدة pk للتعبير عن القوى النسبية للحمض والأسس الدور المزدوج الذي تلبعه العديد من الأحماض والأسس الضعيفة في الكيمياء الحيوية . فعلى سبيل المثال ، يمكن للسلسلة R لحمض أميني معين في الموقع الفعال لإنزيم ما ان تعمل كمعط للبروتون (أي تعمل كحمض) خلال إحدى مراحل دورة التحفيز وكمستقبل له (أي كأساس) خلال مرحلة لاحقة.
تتبع المعادلات السابقة التي تبين العلاقة بين k وتركيز أيونات الهيدروجين وتركيز الحمض غير المتأين وتركيز أساسه الانضمامي ، ولاحظ ان عندما يكون :
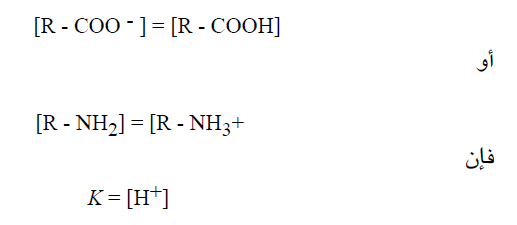
ويمكن التعبير عن ذلك بالكلام التالي : عندما تتساوى تراكيز الشكل البروتوني غير (المتفارق) مع الشكل المتفارق (الاساس الانضمامي) ، تكون قيمة تركيز ايونات الهيدروجين [H+] مساوية رقميا لقيمة ثابتة التفارق K فإذا اخذنا لوغاريتم طرفي المعادلة الاخيرة ثم ضربنا الطرفين بـ 1- ، تصبح هذه المعادلة كما يلي:
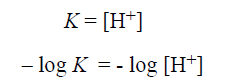
وهذا يعني أن pK الخاصة بمجموعة حمضية هي قيمة الباهاء (pH) التي يوجد عندها الشكل البروتوني والشكل غير البروتوني بتراكيز متساوية.
pK = pH
ولكن تحديد قيمة الـ pK لحمض ما تجريبيا بإضافة نصف مكافئ من الأساس الى كل مكافئ من الحمض ، فتكون قيمة الباهاء (pH) الناتجة مساوية لقيمة الـ pK الخاصة بالحمض.



|
|
|
|
التوتر والسرطان.. علماء يحذرون من "صلة خطيرة"
|
|
|
|
|
|
|
مرآة السيارة: مدى دقة عكسها للصورة الصحيحة
|
|
|
|
|
|
|
نحو شراكة وطنية متكاملة.. الأمين العام للعتبة الحسينية يبحث مع وكيل وزارة الخارجية آفاق التعاون المؤسسي
|
|
|