

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
تصنيع حمض الكبريت بطريقة التلامس
المؤلف:
GEORGE T . AUSTIN
المصدر:
SHREV ‘ S CHEMICAL PROCESS INDUSTRIES
الجزء والصفحة:
ص 558
6-10-2016
31421
تصنيع حمض الكبريت بطريقة التلامس
حتى عام 1900 لم يكن قد بني مصنع بطريقة التلامس في الولايات المتحدة ، مع ان هذه الطريقة اكتسبت اهمية في اوروبا بسبب الحاجة للأوليوم وللحموض ذات التراكيز العالية من أجل السلفنة ، وخصوصاً في صناعة الأصبغة . وبني عدد هام من هذه المصانع في الفترة بين 1900 الى 1925 ، وكانت تستخدم مواداً بلاتينية للتحفيز . ودخلت محفزات الفاناديوم ميدان الاستخدام في منتصف العشرينات فحلت بصورة شاملة محل البلاتين . واستطاعت طريقة التلامس في عام 1930 ان تنافس طريقة الغرف بغض النظر عن التركيز المطلوب للحمض . ومنذ منتصف العشرينات راحت المنشآت الحديثة تستخدم طريقة التلامس مع محفزات الفاناديوم .
تعد المصانع التي تحرق الكبريت اكثر بساطة واقل كلفة لان التنقية الخاصة لغاز الاحتراق من اجل حماية مادة التحفيز غير لازمة. في الشكل المفرد للامتصاص ، الذي كان الاجراء الطبيعي حتى السبعينات ، كان الاهتمام قليلا بالتخطيط لاستراد الحرارة بشكل فعال بحسنه ممكن استرداد كل الحرارة المنبعثة من الاحتراق والتحويل على شكل بخار عالي الضغط نسبيا .
عند استخدام مواد اخرى كخامات السلفيد والحموض المستهلكة او حموض الكدارة. ، يجب تنقية الغاز بشكل شامل ، وبجب تسخين غاز SO2 في مبادلات حرارية قبل دخوله المحول التحفيزي وذلك بالحرارة المتشكلة في المفاعل .
تستعاد الحرارة المتطورة من تحميص الخامة او من حرق الحمض المستهلك على شكل بخار منخفض الضغط.
جرى تدريجيا تعديل طريقة التلامس لاستخدام امتصاص مضاعف ( ويدعى ايضا المحفز المضاعف ) ، الذى يزيد في المردود وينقص اطلاق SO2 غير المحول . وحددت التنظيمات الحكومية في الولايات المتحدة مؤخرا الأطلاق الأقصى المسموح به في مصانع الحمض ، الامر الذى يفرض على كل المصانع الحديثة استخدام طريقة الامتصاص المضاعف او ان تكيف مع اجهزه لتنظف غاز المداخن لتحقيق معدلات اطلاق مماثلة .
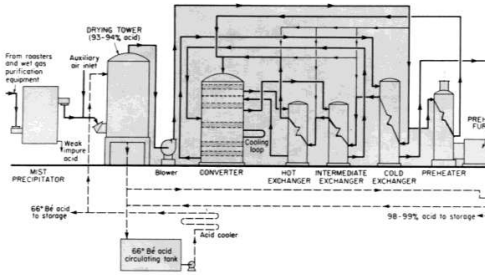
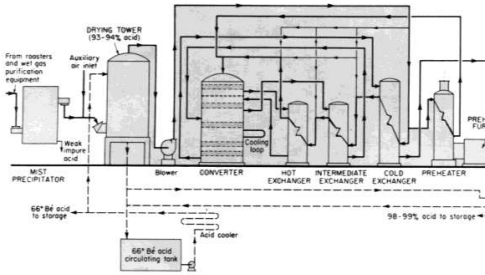
مخطط نموذجي للإنتاج في مصنع لحمض الكبريت بطريقة التلامس والامتصاص المفرد وحرق الكبريت. مع ضخ الهواء ( للتمديد ) او التبريد بين المراحل الانبعاثات المسموح بها في مصانع حرق الكبريت تكافئ تحويل 99.7 % من SO2 ، وفي المصانع التي تستخدم غازات المصاهر تصل هذه النسبة الى تحويل 99-99.5 % تقريبا .
نموذجيا ، بلغت نسبة التحويلات التي تستخدم طريقة الامتصاص المفرد بالتلامس 97 - 99 % . وعلى الرغم من ان بعض المصانع تستخدم الكسح القلوي للغازات المطروحة لإبقائها ضمن الحد ، فان معظم المصانع الحديثة تستخدم الامتصاص المزدوج . حيث ، يعاد تسخين الغازات التي تغادر برج الامتصاص الاول عن طريق التبادل الحراري مع غازات المحول السفلي وتدخل مجددا المرحلة النهائية للمحول . وبسبب انخفاض محتوى ثالث اكسيد الكبريت ، يستطيع التفاعل :
SO2 + ½ O2 ⇋ SO4
ان يتقدم الى حد ابعد في الاتجاه المرغوب ، وبذلك يمكن التوصل الى استرداد اعلى يصل الى 99.7 % . تبرد الغازات التي تغادر المرحلة النهائية ويجري امتصاص SO3 في برج الامتصاص الاخير .
يستفاد من حرارة حرق الكبريت في تسخين المراجل او المراجل والموفرات التي تسخن بالحرارة المهدورة لتوليد البخار لصهر الكبريت ولأغراض الامداد بالطاقة في المصنع . تولد المصانع الحديثة بخارا عند MPa 6 ، مقاربة بـ MPa 2 للمصانع الاقدم .
قام فريدمان بإجراء تحليل رائع لاستخدام الطاقة في مصانع حمض الكبريت . من الطبيعي ان يتجاوز البخار المتولد في المصانع الكبرى لحرق الكبريت ( الصورة 1 - 2 ) 1.3 طنا لكل طن متري من الحمض المنتج . ولكن يمكن انتاج غاز اقل بكثير عند وجود جهاز لتنقية الغاز .
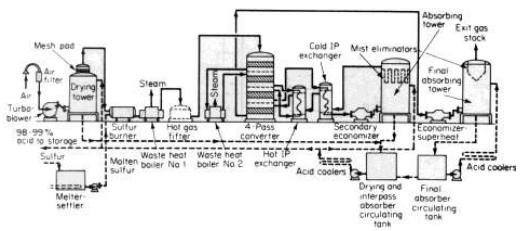
الصورة 1- 1 . مخطط نموذجي للإنتاج في مصنع لحمض الكبريت بطريقة التلامس وحرق الكبريت والامتصاص المزدوج .
ففي السويد ، يوصل مصنع طاقته 2200 طنا في اليوم 52 MW من الحرارة الى نظام التدفئة في المنطقة ، فيوفر 35700 طنا من زيت الفيول يوميا .

ان اكسدة ثاني اكسيد الكبريت في محولات مصنع التلامس تشكل مثالا لكثير من التطبيقات الصناعية لمبادئ الكيمياء الفيزيائية .
التفاعل من SO2 الى SO3 تفاعل ناشر للحرارة . ويمكن توضيح ثابت التوازن لهذا التفاعل ، الذي يحسب من الضغوط الجزئية وفقا لقانون فعل الكتلة ، بــ :
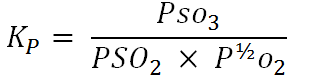
صورة 1-2 : مخطط نموذجي للإنتاج في مصنع لحمض الكبريت بطريقة التلامس والامتصاص المفرد وتحميص الخامات .
مستثمر: يبلغ 3 - 4 اضعاف مثيله في مصنع لحرق الكبريت بما فيه اجهزة التحميص وتنقية الغاز .
كانت قيم Kp قد حددت تجريبيا على اساس وحدات الضغط الجوي ، كما تظهر في الجدول 1 - 1 ، وهي ثابتة بالنسبة لأي درجة حرارة مفترضة . وتتفق هذه القيم التجريبية مع قيم Kp المحسوبة من المعلومات الديناميكية الحرارية .
تبين الصورة 1- 2 تحويل توازن SO2 الى SO3 كتابع لدرجة الحرارة من اجل تغذيتين لتراكيز اولية مختلفة SO2 . جرى حساب هذه التحولات
الجدول 1 - 1 . ثوابت التوازن لتأكسد ثاني اكسيد الكبريت.
|
درجة الحرارة (مئوية) |
|
درجة الحرارة (مئوية) |
|
|
400 |
397 |
800 |
0.915 |
|
500 |
48.1 |
900 |
0.384 |
|
600 |
9.53 |
1000 |
0.1845 |
|
700 |
2.63 |
1100 |
0.0980 |
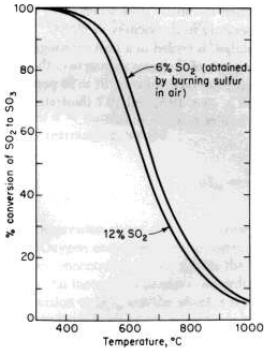
الصورة 1 - 3 . علافة التوازن - درجة الحرارة لتحويل SO2 الى SO3 .
في التوازن من القيم التجريبية Kp ( الجدول 1- 1 ) ، على فرض ان كل الغازات مثالية وان اجمالي الضغط هو (1atm) Kpa 101 .
تبين معلومات تحويل التوازن في الصورة 1-3 ان تحويل ثاني اكسيد الكبريت يقلل من ارتفاع درجة الحرارة . ولهذا السبب ، مصبح من المرغوب فيه اجراء التفاعل عند ادنى درجة حرارية يمكن استخدامها .
عند 400 مئوية ، حيث نرى في الصورة 1- 3 ان حالة التوازن ايجابية جدا ، لكونها 100 % تقريبا ، تكون سرعة بلوغ هذا التوازن بطيئة . والسرعة عند 500 مئوية تكون اكبر بـ 10- 100 مرة منها عند 400 مئوية ، وتكون اسرع ايضا عند 550 مئوية . وبما ان التفاعل العكسي
SO3→ SO2 + 1/2 O2
لا يصبح محسوسا حتى تصل درجة الحرارة الى 550 مئوية ، لذلك يستحسن ان يبدا التفاعل عند هذه الدرجة لتحقيق سرعات عالية ، تقدم تحويلا اقصى بأدنى قدر من مادة التحفيز .
هناك تعارض عادي بين التوازن الايجابي للتحويل عند درجات الحرارة المنخفضة والسرعات الايجابية عند درجات الحرارة الاعلى . يستفيد الاجراء العملي في مصنع التلامس من اعتباري السرعة والتوازن عن طريق سماحه : اولا ، بالدخول فوق جزء من مادة التحفيز عند درجة حرارة تتراوح بين 435 - 440 مئوية ، ثم بالسماح لدرجة الحرارة بالارتفاع مع تقدم التفاعل بدون تبادل حراري . تزداد سرعة التفاعل مع ارتفاع درجة الحرارة ، لكنها بعدئذ تبدأ بالهبوط ببطء مع الاقتراب من التوازن .
يتوقف التفاعل بصورة اساسية بعد تحول ما يقرب من 60 - 77 % من SO2 ، عند درجة حرارة قريبة من 600 مئوية . وعندئذ وبعد ان يمر الغاز فوق بقية المادة الحفازة ، يبرد في مبادل حراري ، في مرجل يسخن بالحرارة المهدورة ، او بواسطة اخرى بحيث لا ترتفع درجة حرارة الغازات المارة فوق اخر جزء من المادة الحفازة الى اكثر من 430 مئوية . يصل المردود باستخدام هذا الاجراء الى 97 - 98 % ، ويكون اجمالي التفاعل سريعا جدا .
وبإعادة كتابة التعبير من اجل Kp بالكسور المولية والضغوط الاجمالية للمعادلة
O2 + 2SO2 ⇋ SO3
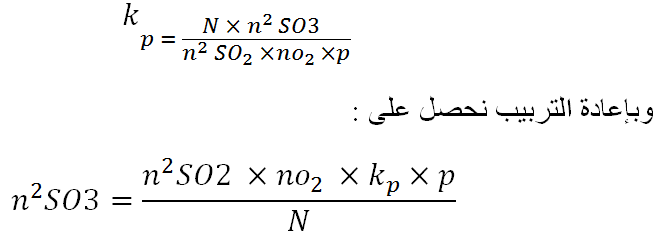
يبين هذا التعبير ان زيادة SO2 او الاكسجين تزيد التحويل الى SO3 . حاول بعضهم القيام بإغناء غاز المحول بالأكسجين لكن المحاولة لم تنجح على الصعيد التجاري . ان ازداد تركيز الاكسجين في غاز الحارق ، يعني انخفاض تركيز SO2 ، والعكس بالعكس . وزيادة ما في الضغط ، وفقاً لمبدأ شاتلييه Le Chatelier ، ستزيد ايضا التحويل الى SO3 ، ولكن التأثير لن يكون كبيراً .
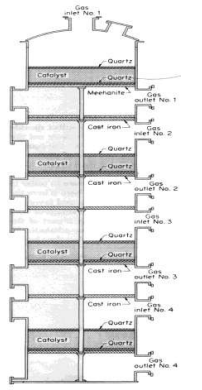
الصورة 1 - 4 . محول مونسانتو ذو الممرات الاربعة . في المصانع التي يتوجب فيها تسخين غاز SO2 البارد بواسطة الحرارة الموجودة في غاز SO2 ، يرتبط كل من المخارج الاربعة للغاز باستثناء رقم 3 بمبادل حراري انبوبي . وكل مخرج من مخارج الغاز ، باستثناء الرقم 4 ، هو من اجل الربط الراجع من المبادل . يربط مخرج الغاز رقم 3 ومدخله رقم 4 الى مبرد مداخن صغير يمكن منه طرح الحرارة لأنها قليلة الكمية ولا حاجة لتسخين مسبق لغاز SO2 ( الصورة 1- 1 ).
 الاكثر قراءة في مواضيع عامة في الكيمياء الصناعية
الاكثر قراءة في مواضيع عامة في الكيمياء الصناعية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















