

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
حمض الآزوت Nitric Acid
المؤلف:
GEORGE T . AUSTIN
المصدر:
SHREV ‘ S CHEMICAL PROCESS INDUSTRIES
الجزء والصفحة:
ص 433
4-10-2016
21504
حمض الآزوت Nitric Acid :
عرف حمض الازوت واعترف بأهميته منذ امد طويل . والطريقة العادية القديمة لتحضير تقضي بتقطير النترات saltpeter مع حمض الكبريت . ويشكل البرق كميات هامة منه في الجو يمكن حرق الامونيا في الهواء بوجود محفز بلاتيني ، ويمكن اكسدة اكاسيد النتروجين المتشكلة الى حد ابعد وامتصاصها في الماء لتشكيل حمض الازوت .
ان انخفاض كلفة الامونيا جعل هذه الطريقة اقل كلفة من كلفة الطريقة القديمة بتركيبه من ملح البارود الشيلي .
الاستخدامات والاقتصاديات : يستخدم معظم حمض الازوت في تصنيع نترات الامونيوم . وتستخدم كميات اساسية منه في تصنيع النترات الاخرى ، العضوية واللاعضوية ، اضافة الى استخدامه في تصنيع مركبات النتروجين العضوية . ويجري انتاج نترات الصوديوم ، والنحاس ، والفضة على نطاق واسع. وتتضمن الاستخدامات المباشرة لحمض الازوت الحفر الفوتوغرافي ، واستخلاص الذهب والفضة .
ان ما تحتويه الصخور الفوسفاتية المستخدمة في الاسمدة من الفسفور يجعلها مفيدة للاستخدام النباتي بعد تحميضها بحمض الكبريت . والتحميض بحمض الازوت يضيف مخصبا نتروجينيا مرغوبا الى الفسفور الموجود سابقا . يتجبل سماد الازوت المحمض اثناء التخزين ، ولكن يجري بالتدريج التغلب على هذه الصعوبة، ويتوقع ان تتوسع السوق امام هذا النوع من السماد .
النترات العضوية ( نتروغليسرين ، ونترات غليكول ، ونترات السليولوز ) ومركبات النترو (TNT ، و RDX ، وحمض البكريك) تحتاج جميعها الى حمض الازوت لتركيبها . والنتروبرافينات Nitroparaffins تصنع ايضا على نطاق واسع عن طريق نترجة الطور البخاري مع حمض الازوت . وخصائص الاكسدة القوية التي يحملها حمض الازوت في المحاليل المخففة مفيدة جدا في بعض الاحيان مع انها في العادة مرفوضة جدا في التراكيب العضوية .
تصنع الاصناف التجارية من حمض الازوت لتحقيق الشروط ، وهي في العادة 36 - 42 بوميه (w / w 53.4 - 68.7 %) . يصنع الحمض ذي التركيز العالي ( 94.5 - 95.5 % ) ، والذى يعرف في السوق التجارية تحت اسم الحمض ´´ المركز " في مصانع مصممة على نحو خاص ، وهو اكثر كلفة. ويمكن تصنعه من حمض اضعف بالتقطير الاستخلاصي مع عوامل قوية مزيلة للماء كحمض الكبريت وسلفات المغنزيوم .
المواد الخام : المواد الاساسية هي : الامونيا ، والهواء ، والماء ، والمادة الحفازة من شبك البلاتين - الروديوم 10 % . ومن المرغوب فه عاده ان مكون الموقع تقريبا من احد مصانع الامونا. وبما ان 17 كغ من الامونيا ، او 105 كغ من حمض ازوث 60 % تحتوى ( كغ من النتروجين ، فقد يجد المصنعون الكبار ان نقل الامونيا اقل كلفة من نقل حمض الأزوت . وتستخدم مركبات وشاحنات الستانلس ستيل للتعامل مع محاليل حمض الأزوت .
التفاعلات وتبدلات الطاقة : اعتبرت التفاعلات التالية ذات اهمية كبيرة في تصنيع حمض الآزوت :
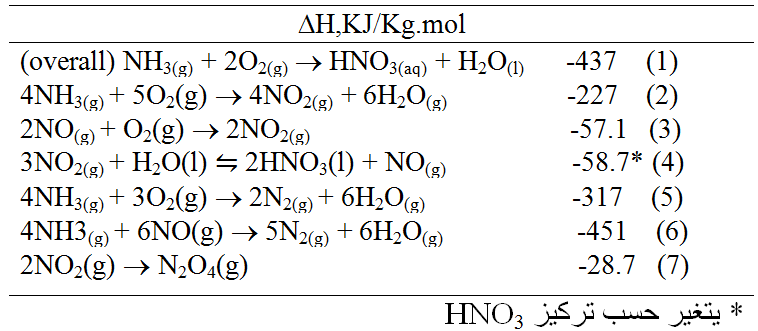
يشار الى المزائج الغازية لأكاسيد النتروجين ( NO,N2O3,NO2,N2O4 ) عادة كـ NOX بغض النظر عن التركيب .
يحتوي الحمض المصنع على بعض من حمض النيتروز (HNO2) عندما يكون التركيز بين 20-45 % HNO3 W/W و على N2O4 المنحل عندما يزيد التركيز عن 55 % ، إن إمكانية تأكسد حمض 20 – 45 % تثبت النتروجين الثلاثي التكافؤ (HNO2) ، واكثر من 55 % تثبت النتروجين الرباعي التكافؤ (, N2O4) .
التفاعل ( 2 ) تفاعل سريع ( عندما يحفز ) ، ويكتمل خلال اقل من 1 / 1000 / ثا . ولذلك يجب اجراؤه كتفاعل أدياباتي ( كظوم ) reaction adiabatic . كما يجب تحديد نسبة الامونيا في هواء التغذية بحيث لا تتلف درجة الحرارة القصوى التي يتم الوصول اليها المادة الحفازة المكلفة .
والتفاعل ( 3 ) تفاعل بطيء غازي الطور حركيته kinetics من الدرجة الثالثة وتزداد سرعته مع ارتفاع درجة الحرارة . ولكن اكتماله الى NO2 ليس عمليا من الناحية التجارية .
ويظهر التفاعل (4) عدة ملامح مزعجة على الرغم من اعتدال سرعته والانخفاض النسبي في ∆H . والاقتراب من التوازن سريع بدرجة معقولة ، لكن التوازن غير ملائم تماما . وينعكس التفاعل اذا كان تركيز الحمض عاليا او اذا كان حارا جدا . تبين الصورة ادناه توازن التفاعل ( 4 ) في التخطيط البياني اللوغاريتمي كـ (PNO/P3NO2) في الطور الغازي مقابل النسية المئوية لـ HNO3 في الطور السائل مع درجة الحرارة كدليل .
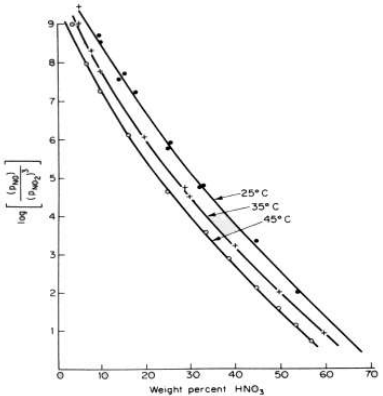
وتفاعل الامتصاص عمليا اكثر تعتيدا مما يشير اليه التفاعل (4) ، لان NO2 ، و N2O3 ، و N2O4 ، و HNO2 جميعها تمتص وتتفاعل لإنتاج HNO3 ، ولكن ثلث الغازات المنحلة يفصل بعدئذ على شكل NO ، فيحتاج الى اعادة الاكسدة وتجديد الامتصاص ، فك تبقى منه الا كمية قليلة جدا. ومن هنا نرى ان هذه الطريقة تستنزف الوقت .
 الاكثر قراءة في مواضيع عامة في الكيمياء الصناعية
الاكثر قراءة في مواضيع عامة في الكيمياء الصناعية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















