

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
الأشكال التأصلية للكبريت
المؤلف:
أ.د. محمد مجدي عبد الله واصل
المصدر:
أسس الكيمياء الصناعية
الجزء والصفحة:
ص309-311
2025-02-09
1321
إن خاصية التأصل (Allotropy) تعتبر خاصية عامة تتميز بها كل عناصر عائلة الأكسجين فقد أمكن التعرف على أشكال عديدة في حالات بلورية مختلفة للكبريت كما أمكن التمييز بين ثلاثة أشكال للكبريت في الحالة السائلة ومع ذلك فإننا سوف نناقش أهم شكلين تأصليين للكبريت في حالته البلورية وشكلين تأصليين للكبريت في حالته السائلة, عند درجة الحرارة العادية يوجد الكبريت على حالة بلورات صفراء شفافة شكلها بلوري ينتمي إلى مجموعة البلورات المعينة Rhombic Crystals والتي توجد فيها الوحدات الجزيئية على هيئة الحلقات الثمانية و8Sوإذا تم تسخين هذه البللورات المعينة عند درجة حرارة أعلى من 96م فإنها تفقد شفافيتها وينتج من تمددها انخفاض في كثافتها ثم تتكون بعد ذلك عدد كبير من البللورات وحيدة الميل Monoclinic Crystals وذلك بعد أن تنظم الحلقات الثمانية S نفسها للتتخذ مكانها فى الشكل البللوري الجديد ويمثل الشكل البللوري وحيد الميل للكبريت الحالة الثانية له عند درجات الحرارة التي تتدرج من 96م حتى درجة إنصهاره وهى 119°م ، حيث أنها تتحول فوق هذه الدرجة إلى سائل أصفر خفيف . يغلب في تركيبه وجود هذه الوحدات الثمانية 8S فإذا استمر ارتفاع درجة الحرارة لهذا الكبريت السائل فإن لزوجته تزداد حتى يصل درجة الحرارة إلى 200م عند هذه الدرجة تكون لزوجة الكبريت السائل عالية جداً لدرجة أن السائل لا يمكن صبه كما يتغير اللون في نفس الوقت من لون بني إلى لون بني محمر غامق) ولقد فسرت الزيادة في لزوجة الكبريت السائل عند التسخين إلى أنه بعملية التسخين هذه يتم تكسير الوحدات الجزيئية S التى توجد على هيئة حلقات فتصبح هذه الوحدات على هيئة سلاسل من ذرات الكبريت المتصلة ببعضها. في العادة يطلق على الكبريت السائل الذي يحتوي على الحلقات الثمانية 8S بالكبريت ʎS وعلى الكبريت السائل الذي يحتوى على سلاسل الكبريت بالكبريت ɥ Sيصبح الكبريت عند درجة حرارة أعلى من ْ250م أقل لزوجة وتقل هذه اللزوجة بالتدريج مع ارتفاع درجة الحرارة حتى تصل درجة الحرارة إلى درجة غليان الكبريت 445 ْم فعندها يمكن صب الكبريت السائل بسهولة، ومن الجدير بالذكر أنه عند صب الكبريت المغلي في وعاء به ماء فإننا نحصل على صورة أخرى من صور الكبريت تشبه المطاط الشفاف يطلق عليها اسم Plastic Sulphur التي تحتوى على نفس النسبة من ʎS ɥS كما توجد في الكبريت المغلي .
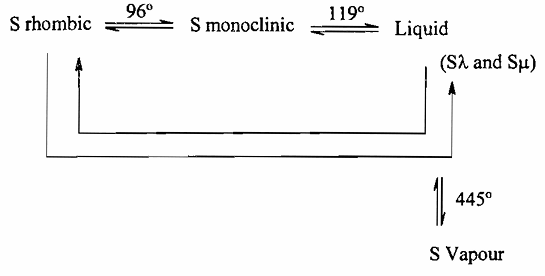
عند درجة الغليان يتكون بخار الكبريت من الجزيئات S ولكن عند درجة حرارة أعلى فإن هذه الجزيئات تتفكك وتتحول إلى جزيئات أصغر S2 يمثل المخطط السابق حالات الانتقال المختلفة للأشكال التأصلية للكبريت.
 الاكثر قراءة في مواضيع عامة في الكيمياء الصناعية
الاكثر قراءة في مواضيع عامة في الكيمياء الصناعية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















