
التحلل الكهربائي لكلور المغنزيوم
 المؤلف:
GEORGE T . AUSTIN
المؤلف:
GEORGE T . AUSTIN
 المصدر:
SHREV ‘ S CHEMICAL PROCESS INDUSTRIES
المصدر:
SHREV ‘ S CHEMICAL PROCESS INDUSTRIES
 الجزء والصفحة:
ص 430
الجزء والصفحة:
ص 430
 22-9-2016
22-9-2016
 2141
2141
التحلل الكهربائي لكلور المغنزيوم :
نحصل على كلوريد المغنزيوم الذي يلزمنا من :
(1) المحاليل الملحية
(2) مياه الابار المالحة
(3) تفاعل هيدروكسيد المغنزيوم ( من مياه البحر او الدولوميت ) مع حمض الهيدروكلوريك (الصورة 14-5) .
قامت الشركة الرائدة للإنتاج ، شركة داو الكيميائية ، في فريبورت وفيلاسكو ، في تكساس ، بتحضير المغنزيوم عن طريق التحلل الكهربائي لكلوريد المغنزيوم من مياه البحر ، مستخدمة اصداف المحار بدلا من الجير اللازم . ولهذا الغرض ، تحرق هذه الاصداف ، المؤلفة من كربونات الكلسيوم النقية ، وتطفأ ، وتمزج بمياه البحر ، وعندها يترسب هيدروكسيد المغنزيوم ( الصورة 1 - 1 ) . يصفى هيدروكسيد المنغزيوم ويعالج بحمض الهيدروكلوريك المتشكل من الكلور المنطلق من الخلايا . فيتشكل محلول كلوريد المغنزيوم الذي يبخر في اجهزة تبخير بنار مباشرة الى كلوريد مغنزيوم صلب ، ويعقب ذلك تجفيف في رفوف . يميل الكلوريد الى التفكك اثناء التجفيف .
وبعد تجفيفه ، يلقم كلوريد المغنزيوم الى الخلايا الالكتروليتية ، حيث يتحلل الى المعدن وغاز الكلور . وهذه الخلايا عبارة عن اوعية مستطيلة كبيرة من الفولاذ المغلف بالخزف ، بعرض 5.1 م ، وطول 3.30 م ، وعمق 8.1 م ، وتتسع لحوالي 9 طناً من كلوريد واملاح المغنزيوم المنصهرة . تعمل الاجزاء الداخلية للخلية ككاثود ، ويتدلى من اعلى الخلية 22 أنوداً من الغرافيت . والترتيب هنا شبيه جداً بالترتيب في خلية الصوديوم عند داونز Downs Sodium cell ( الصورة 1 - 3 ) .
يضاف كلوريد الصوديوم الى المغطس لخفض نقطة الانصهار وزيادة الموصلية ايضاً . يحافظ على الاملاح في حالة انصهار بواسطة تيار كهربائي يستخدم لاستخلاص المغنزيوم اضافة الى الحرارة الخارجية التي تؤمنها الافران الخارجية المسخنة بالغاز . تبلغ درجة حرارة التشغيل العادية 710 مئوية ، وهي تكفي لصهر المغنزيوم ( نقطة الغليان 651 مئوية ) . تعمل كل خلية عند 6 فولط و 80000 - 100000 امبير ، بكفاءة تيار تزيد عن 80 % . يحتاج المغنزيوم الناتج الى 63.4 MJ/Kg من الطاقة . ويتحرر المغنزيوم المنصهر عند الكاثود ويرتفع الى سطح المغطس ومنه الى احواض معدنية امام الخلية يجرف المغنزيوم بنقاوة 99.9 % عدة مرات في اليوم ، ويحتوي كل مغطس على معدن بما يكفي لمل ، قالب تكوير ذاتي سعة 20 كغ .
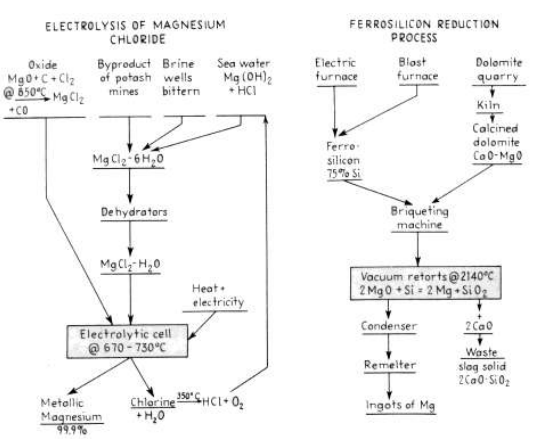
الصورة 1 - 1 . مخطط مجمل للمعالجات البديلة لإنتاج المغنزيوم المعدني .
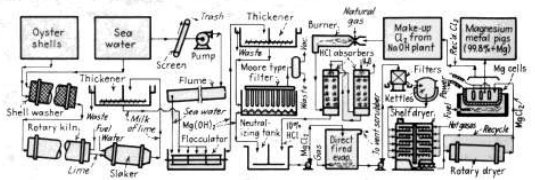
الصورة 1 - 3 . معدن المغنزيوم من مياه البحر- طريقة داو.
الصورة 1 - 3 . خلية الصوديوم عند داونز . (A ) انود غرافيتي ، (B) كاثود حديدي ، ( F ) قبة لجمع الكلور ، ( K) انبوب لنقل الكلور بعيدا ، (G) مجمع حلقي للصوديوم ، (H) و (I) انابيب لتوصيل الصوديوم الى الوعاء (J) ، (L) و (M) مناخل معدنية مدعمة بـ (F) وتعمل لفصل النواتج الخلوية ، (C) غلاف الخلية مصنوع من الفولاذ لكنه مبطن باجر مقاوم للصهر ، (N) باب لشحن الملح ، و (O) مستوى المغطس .
 الاكثر قراءة في مواضيع عامة في الكيمياء الصناعية
الاكثر قراءة في مواضيع عامة في الكيمياء الصناعية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


