
الموقع الفعال The Active site
 المؤلف:
د. طارق يونس احمد / د. لؤي عبد علي الهلالي
المؤلف:
د. طارق يونس احمد / د. لؤي عبد علي الهلالي
 المصدر:
الكيمياء الحياتية
المصدر:
الكيمياء الحياتية
 الجزء والصفحة:
ج 1 ص 294
الجزء والصفحة:
ج 1 ص 294
 2023-11-22
2023-11-22
 3179
3179
الموقع الفعال هو تلك المنطقة التي ترتبط بها المواد الأساس والمجاميع المرتبطة الأخرى إن وجدت) والذي هو عبارة عن وحدات من الأحماض الأمينية في الإنزيم، تشترك في عملية التحفيز، ويكون على شكل حفرة أو التفاف لسلسلة متعدد الببتيد. وعلى الرغم من الاختلاف التركيبي الكبير بين الإنزيمات فأنه يمكــن تعميم بعض الظواهر الخاصة بالمواقع الفعالة التي يمكن تحديدها بما يأتي:
1- تؤلف المواقع الفعالة جزءاً صغيراً من الحجم الكلي للإنزيم وبذلك فان معظم الأحماض الأمينية فــــــي الإنزيم ستكون بعيدة إلى حد ما عن المادة الأساس.
2- يتميز الموقع الفعال بكونه ثلاثي الأبعاد فهو ليس بالنقطة ولا بالخط المستقيم ولا حتـــى بالمستوي. ويترتب الشكل الثلاثي الأبعاد من مجاميع مختلف لأنحاء مختلفة من سلسلة الأحماض الأمينية التعاقبية في الإنزيم فمثلاً قد تكون الأحماض الأمينية في مواقع 35,62,62,63 101 , تشارك فــــــي الموقع الفعال ( الشكل 20-10).
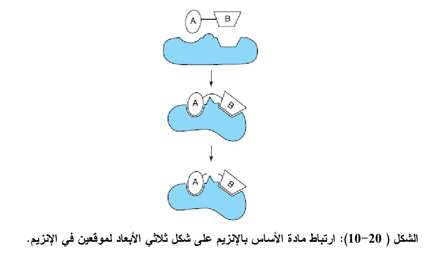
3- ترتبط المواد الأساس بإنزيماتها بقوى ضعيفة نسبيا، فقد اتضح أن ثوابت اتزان معقدات [ES] تتراوح عادة بين8- 10 و 2- 10 مول وتبين أيضاً عند حساب طاقة التفاعل الحرة إنها تتراوح بين – 3 و -12 كيلو سعرة/ مول وعند مقارنة هذه الأرقام مع قوة الارتباط التساهمي التي تتراوح بين – 50 و 110 كيلو سعرة/ مول نجد أنها ليست بتلك القوة التي يحسب حسابها.
4- المواقع الفعالة في الإنزيم عبارة عن شقوق (حفر) في الإنزيم (الشكل ( 21-10) والتي ترتبط بها المواد الأساس وان خصوصية الارتباط تعتمد على الترتيب الدقيق للذرات التي تحويها الأحماض الأمينية في الموقع الفعال.
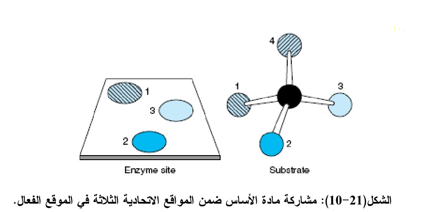
5- هناك نظريتان تتضمنان اتحاد المادة الأساس بالموقع الفعال وتكوين الإنزيم - المادة الأساس المعقد وهما:
أ- نظرية القفل والمفتاح Lock and key theory
اقترحت هذه النظرية من قبل الباحث إميل فيشر Emil Fischer في سنة 1890، ففـ هذه النظرية وبسبب خصوصية الإنزيم فأنه يتحد مع . مادة أساس ذات شكل ملائم تماماً للموقع الفعال اذ يؤثر المفتاح (المادة الأساس على قفل واحد فقط وليس كل المجموعات الموجودة بجزيئة الإنزيم (الشكل22-10 أ و ب). ومن عيوب هذه النظرية هي صلابة أو عدم مرونة الموقع الفعال بالنسبة للمادة الأساس وتنطبق هذه النظرية على عدد من الإنزيمات ذات الحركية البسيطة.
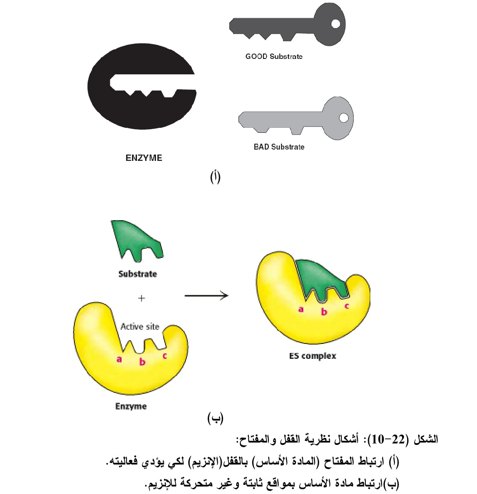
ب- نظرية الحث التوافقي Induced fit theory
يعتمد اتحاد مادة الأساس مع الموقع الفعال للإنزيم على المجاميع الجانبية (R-group) للأحماض الأمينية في الموقع الفعال والتي تشترك جميعاً في عملية الاتحاد ويمكن تصنيف وحدات الأحماض الأمينيـة فـــي الموقع الفعال إلى أربع مجاميع، وهي:
1- وحدات اتحادية: التي تتحد مع مادة الأساس.
2- وحدات تحفيزية : مسئولة عن التغيرات الكيميائية.
3- وحدات تركيبية: التي تحافظ على التركيب ثلاثي الأبعاد للإنزيم
4- وحدات غير أساسية :التي تكون على سطح الإنزيم ولا تشارك في عملية التحفيز .
تشترك المجاميع الأربعة أعلاه في عملية الاتحاد مع المادة الأساس، ويمكن تشبيه نظرية التوافق المستحث بالقفاز الذي يغير من شكله عند دخول اليد فيه، فالقفاز هنا، يعد الموقع الفعال في الإنزيم واليد هي المادة الأساس. إن أهم ملامح نظرية التوافق المستحث هي مرونة الموقع الفعال (الشكل 23-10). إذ حالما تضاف المادة الأساس للإنزيم فأن الموقع الفعال في هذا الإنزيم يتحور بشكل خاص ليتمكن من الارتباط بالمادة الأساس، أي إن شكل الموقع الفعال لا يتخذ الشكل المشابه للمادة الأساس إلا حين يرتبط بها لذلك سميت الحالة الديناميكية هذه بنموذج الحث التوافقي Induced fit.

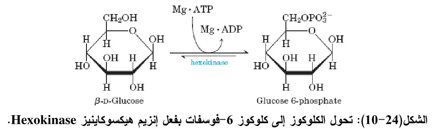
يعد إنزيم الهيكسوكاينيز Hexokinase احد الأمثلة على نموذج التوافق المستحث والذي يعمل علــى تحويل السكريات السداسية (مثل الكلوكوز) الى كلوكوز -6 فوسفات كما في المعادلة الآتية:
 الاكثر قراءة في الفيتامينات والمرافقات الانزيمية
الاكثر قراءة في الفيتامينات والمرافقات الانزيمية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


