
ذوبانية البروتينات Solubility of proteins
 المؤلف:
د. طارق يونس احمد / د. لؤي عبد علي الهلالي
المؤلف:
د. طارق يونس احمد / د. لؤي عبد علي الهلالي
 المصدر:
الكيمياء الحياتية
المصدر:
الكيمياء الحياتية
 الجزء والصفحة:
ج 1 ص 154-156
الجزء والصفحة:
ج 1 ص 154-156
 2023-11-14
2023-11-14
 3727
3727
البروتينات تحتوي على مجاميع مختلفة من الحامضية - القاعدية وبالتالي فهي تختلف في الذوبانية بالاعتماد على عدة عوامل منها: تراكيز الأملاح المذابة وقطبية المذيب والأس الهيدروجيني pH ودرجــة الحرارة. وفيما يأتي وصف للعوامل المؤثرة على ذوبانية البروتينات:
1- تتأثر درجة الذوبانية للبروتينات كثيراً بقيمة pH نظراً لسلوكها الأمفوتيري. اذ ان درجــة الذوبانيـــة تكون عند أدنى مستوياتها ازدياد ترسيب (البروتين) في نقطة التعادل الكهربائي Isoelectric point PI (نقطة التعادل الكهربائي هي تلك الـ pH التي تكون فيها محصلة الشحنة على البروتين صفراً ولا تتحرك في المجال الكهربائي) (الشكل (22-6) وتزداد كلما ابتعدنا عن هذه النقطة في الاتجاهين الحامضي او القاعدي.
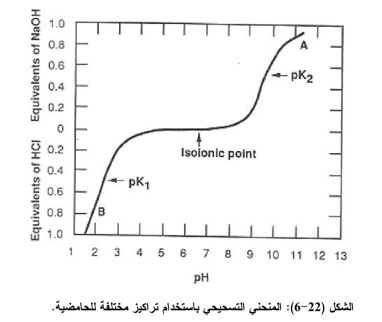
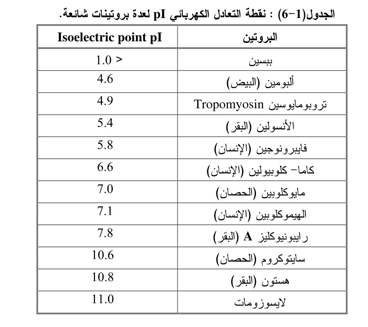
فعند نقطة التعادل الكهربائي تكون قوى التنافر الإلكتروستاتيكي Electrostatic repulsion forces بين جزيئات المذاب على أدناها وتكون قوى التشابك البلورية Crystal - lattice forces للحالة الصلبة على أعلاها (زيادة الترسيب) إلا أن معظم الجزيئات الأمفوتيرية توجد إما على هيئة أنيونـــات (سالبة) أو كاتيونات(موجبة) وأن قوى التنافر بين الأيونات تكون كبيرة لان جميع الجزيئات تمتلك شحنات كثيرة مـــــن نفس العلامة وبهذا تزداد درجة الذوبان مقارنة بنقطة التعادل الكهربائي. وفيما يأتي جدول يوضح قيمة pI لعدة بروتينات شائعة.
-2ذوبانية البروتين في المحاليل المائية تتأثر بتراكيز الأملاح المذابة في المحلول فعند استخدام كبريتــــات الأمونيوم يلاحظ بأنه يعمل على ترسيب العديد من البروتينات ولكل بروتين هناك كمية معينة من الملح المستخدم لترسيبه والذي يعتمد على القوى الأيونية للملح الذي يمكن حسابه من المعادلة الآتية:
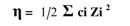
اذ η تمثل القوة الأيونية، و ∑ علامة الجمع، و ci التركيز المولاري لكل أيون، و Z الشحنة التـي يحملها كل أيون.
إن البروتينات ذات الشكل الكروي Globular لا تذوب إلا قليلاً في الماء وتزداد درجة ذوبانها كثيـــراً بفعل الأملاح المتعادلة المستخدمة مثل كبريتات الأمونيوم (NH4)2SO4) وكبريتات الصوديوم Na2SO4 وكبريتات البوتاسيوم K2SO4 وكلوريد المغنيسوم MgCl2 وكبريتات المغنيسيوم MgSO4. ان سبب ترسب البروتينات (قلة الذوبانية) بوجود تراكيز ملحية عالية هو ان أيونات الأملاح تجذب حــــول نـفـسـها جزيئات الماء القطبية تاركة جزيئات البروتين مما يؤدي الى تجمعها مع بعضها وبالتالي ترسيبها وتدعى هذه الظاهرة الترسيب بالتمليح Salting out بينما التراكيز الواطئة من الأملاح تزيد ذوبانية بروتينات
عديدة وتدعى هذه الظاهرة الإذابة بالتمليح Salting in ويمكن تفسير مثل هذه الظاهرة الى التغيرات الحاصلة في قابلية التأين لمجاميع R القابلة للتفكك Dissociable، اذ كما هو معلوم أن احد العوامل التي تزيد من ترابط البروتين هو اختلاف الشحنات في جزيئة البروتين وتقل باستخدام الأملاح والتي تعمل على أعطاء ايونات ترتبط بمجاميع الشحنات في البروتين وتقلل التداخل وبالتالي زيادة الذوبانية.
3- تقل الذوبانية (بمعنى تزداد الترسيب) للعديد من البروتينات باستخدام مذيبات عضوية مثل الأسيتون والإيثانول والميثانول وذلك بسبب كون تلك المذيبات العضوية لها ثابـت عـزل كهربـائي Dielectric constant أقل من الماء وبالتالي تعمل على زيادة تأصر هيدروجيني مع جزيئات الماء ممــــا يقلل التداخل الحاصل بين البروتين وجزيئات الماء، وبالتالي يمكن استخدام هذه الخاصية في عملية الفصل الجزيئي لبروتينات مختلفة استناداً الى أوزانها الجزيئية أن استخدام عملية الترسيب في المذيبات العضوية تكون عند درجة حرارة مقاربة للصفر المئوي بسبب ارتفاع درجة حرارة المحلول كنتيجة للحرارة المنبعثة من المزج وكون الدرجات الحرارية العالية تعمل بالتالي على مسخ البروتين. وهناك مركبات عضوية على سبيل المثال ثنائي مثيل سلفوکساید Dimethyl sulfoxide و N,N- ثنائي مثيل فورأميــــد N,N dimethyl formamide لهما ثابت عزل كهربائي عال وبالتالي تعد مذيبات جيدة للبروتينات.
4- تقل الذوبانية للبروتينات عند استخدام حوامض مثل ثلاثي : ـورو حامض الخليك Trichloro acetic acid وحامض التنكستيك الفوسفوري Phospho tungistic acid مــن خــلال التغيير الحاصل في الأس الهيدروجيني pH للمحلول المذاب فيه البروتين وتغيير قيمة نقطة التعادل الكهربائي (pI) للبروتين ثم ترسيبه ( عملية الإضافة تؤدي الى مسخ البروتين ثم ترسيبه).
5- الحرارة تساعد في تجلط (تجمع) عدد من البروتينات ورغم ان الحرارة المؤثرة لهذه العملية ما بين 38 و 75 درجة مئوية إلا أن هناك عوامل أخرى تؤثر في عملية تجلط البروتينات ويكون البروتين أسهل تجلطاً عندما يكون في نقطة التعادل الكهربائي له إن نتيجة عملية التجلط لتكوين مواد غير مذابــة Coagulum والتي لا يمكن أذابتها ألا بعد تحللها مائياً أو بعد تفسخها.
6- تكون المعادن الثقيلة مرسبات بروتينية فعالة ولكن هذا يتوقف على تركيز أيون الهيدروجين والحرارة ووجود بعض الأيونات الأخرى. فمثلاً يكوّن كلوريد الزئبق ونترات الفضة رواسب ثقيلة (ذوبانية قليلة جدا) مع البروتينات والتي لا يمكن ان تذوب، بينما كبريتات النحاس وكلوريد الحديديك رواسب بروتينية التي يمكن إذابتها بإضافة زيادة من المادة الأصلية المرسبة.
 الاكثر قراءة في الاحماض الامينية والبروتينات
الاكثر قراءة في الاحماض الامينية والبروتينات
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


