

النبات

مواضيع عامة في علم النبات

الجذور - السيقان - الأوراق

النباتات الوعائية واللاوعائية

البذور (مغطاة البذور - عاريات البذور)

الطحالب

النباتات الطبية


الحيوان

مواضيع عامة في علم الحيوان

علم التشريح

التنوع الإحيائي

البايلوجيا الخلوية


الأحياء المجهرية

البكتيريا

الفطريات

الطفيليات

الفايروسات


علم الأمراض

الاورام

الامراض الوراثية

الامراض المناعية

الامراض المدارية

اضطرابات الدورة الدموية

مواضيع عامة في علم الامراض

الحشرات


التقانة الإحيائية

مواضيع عامة في التقانة الإحيائية


التقنية الحيوية المكروبية

التقنية الحيوية والميكروبات

الفعاليات الحيوية

وراثة الاحياء المجهرية

تصنيف الاحياء المجهرية

الاحياء المجهرية في الطبيعة

أيض الاجهاد

التقنية الحيوية والبيئة

التقنية الحيوية والطب

التقنية الحيوية والزراعة

التقنية الحيوية والصناعة

التقنية الحيوية والطاقة

البحار والطحالب الصغيرة

عزل البروتين

هندسة الجينات


التقنية الحياتية النانوية

مفاهيم التقنية الحيوية النانوية

التراكيب النانوية والمجاهر المستخدمة في رؤيتها

تصنيع وتخليق المواد النانوية

تطبيقات التقنية النانوية والحيوية النانوية

الرقائق والمتحسسات الحيوية

المصفوفات المجهرية وحاسوب الدنا

اللقاحات

البيئة والتلوث


علم الأجنة

اعضاء التكاثر وتشكل الاعراس

الاخصاب

التشطر

العصيبة وتشكل الجسيدات

تشكل اللواحق الجنينية

تكون المعيدة وظهور الطبقات الجنينية

مقدمة لعلم الاجنة


الأحياء الجزيئي

مواضيع عامة في الاحياء الجزيئي


علم وظائف الأعضاء


الغدد

مواضيع عامة في الغدد

الغدد الصم و هرموناتها

الجسم تحت السريري

الغدة النخامية

الغدة الكظرية

الغدة التناسلية

الغدة الدرقية والجار الدرقية

الغدة البنكرياسية

الغدة الصنوبرية

مواضيع عامة في علم وظائف الاعضاء

الخلية الحيوانية

الجهاز العصبي

أعضاء الحس

الجهاز العضلي

السوائل الجسمية

الجهاز الدوري والليمف

الجهاز التنفسي

الجهاز الهضمي

الجهاز البولي


المضادات الميكروبية

مواضيع عامة في المضادات الميكروبية

مضادات البكتيريا

مضادات الفطريات

مضادات الطفيليات

مضادات الفايروسات

علم الخلية

الوراثة

الأحياء العامة

المناعة

التحليلات المرضية

الكيمياء الحيوية

مواضيع متنوعة أخرى

الانزيمات
Enzymes
المؤلف:
Denise R. Ferrier
المصدر:
Lippincott Illustrated Reviews: Biochemistry
الجزء والصفحة:
9-9-2021
1594
Enzymes
Enzymes are protein catalysts that increase the velocity of a chemical reaction by lowering the energy of the transition state (Fig. 1). They are not consumed during the reaction. Enzyme molecules contain a special cleft called the active site, which contains amino acid side chains that participate in substrate binding and catalysis. The active site binds the substrate, forming an enzyme–substrate (ES) complex. Binding is thought to cause a conformational change in the enzyme (induced fit) that allows catalysis. ES is converted to enzyme and product. An enzyme allows a reaction to proceed rapidly under conditions prevailing in the cell by providing an alternate reaction pathway with a lower activation energy (Ea). Because the enzyme does not change the free energies of the reactants or products, it does not change the equilibrium of the reaction. Most enzymes show Michaelis-Menten kinetics, and a plot of the initial reaction velocity (vo) against substrate concentration ([S]) has a hyperbolic shape similar to the oxygen-dissociation curve of myoglobin.
A Lineweaver-Burk plot of 1/v and 1/[S] allows determination of Vmax (maximal velocity) and Km (Michaelis constant, which reflects affinity for substrate). Any substance that can decrease the velocity of an enzyme-catalyzed reaction is called an inhibitor. The two most common types of reversible inhibition are competitive (which increases the apparent Km) and noncompetitive (which decreases the apparent Vmax). In contrast, the multisubunit allosteric enzymes show a sigmoidal curve similar in shape to the oxygendissociation curve of hemoglobin. They typically catalyze the committed step of a pathway. Allosteric enzymes are regulated by molecules called effectors that bind noncovalently at a site other than the active site.
Effectors can be either positive (increase enzyme activity) or negative (decrease enzyme activity). An allosteric effector can alter the affinity of the enzyme for its substrate (K0.5), the maximal catalytic activity of the enzyme (Vmax), or both. Enzymes can also be regulated by covalent modification and by changes in the rate of synthesis or degradation. Enzymes have diagnostic and therapeutic value in medicine.
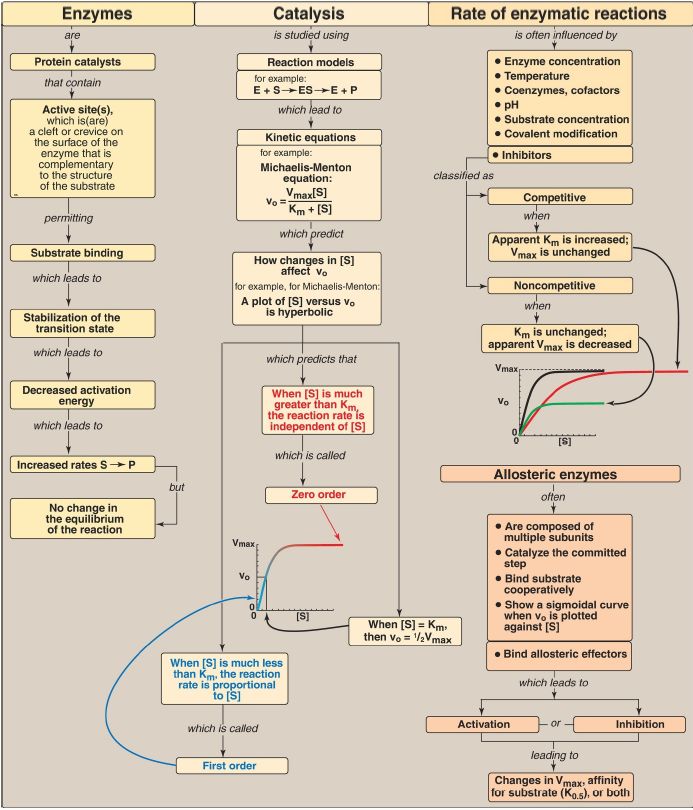
Figure 1: Key concept map for the enzymes. S = substrate; [S] = substrate concentration; P = product; E = enzyme; vo = initial velocity; Vmax = maximal velocity; Km = Michaelis constant; K0.5 = substrate concentration that gives half maximal velocity.
 الاكثر قراءة في الكيمياء الحيوية
الاكثر قراءة في الكيمياء الحيوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















