


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
Read More
Date: 12-4-2017
Date: 11-9-2016
Date: 25-7-2016
|
Solutes Affect the Colligative Properties of Aqueous Solutions
Solutes of all kinds alter certain physical properties of the solvent, water: its vapor pressure, boiling point, melting point (freezing point), and osmotic pressure. These are called colligative (“tied together”) properties, because the effect of solutes on all four properties has the same basis: the concentration of water is lower in solutions than in pure water. The effect of solute concentration on the colligative properties of water is independent of the chemical properties of the solute; it depends only on the number of solute particles (molecules, ions) in a given amount of water. A compound such as NaCl, which dissociates in solution, has twice the effect on osmotic pressure, for example, as does an equal number of moles of a nondissociating solute such as glucose. Solutes alter the colligative properties of aqueous solutions by lowering the effective concentration of water. For example, when a significant fraction of the molecules at the surface of an aqueous solution are not water but solute, the tendency of water molecules to escape into the vapor phase that is, the vapor pressure is lowered (Fig. 1.1). Similarly, the tendency of water molecules to move from the aqueous phase to the surface of a forming ice crystal is reduced when some of the molecules that collide with the crystal are solute, not water. In that case, the solution will freeze more slowly than pure water and at a lower temperature. For a 1.00 molal aqueous solution (1.00 mol of solute per 1,000 g of water) of an ideal, nonvolatile, and non-dissociating solute at 101 kPa (1 atm) of pressure, the freezing point is 1.86 0C lower and the boiling point is 0.543 0C higher than for pure water. For a 0.100 molal solution of the same solute, the changes are one-tenth as large. Water molecules tend to move from a region of higher water concentration to one of lower water concentration. When two different aqueous solutions are separated by a semipermeable membrane (one that allows the passage of water but not solute molecules), water molecules diffusing from the region of higher water concentration to that of lower water concentration produce osmotic pressure (Fig. 1.1). This pressure, measured as the force necessary to resist water movement (Fig. 1.1c), is approximated by the van’t Hoff equation:
II = icRT
in which R is the gas constant and T is the absolute temperature. The term ic is the osmolarity of the solution, the product of the solute’s molar concentration c and the van’t Hoff factor i, which is a measure of the extent to which the solute dissociates into two or more ionic species. In dilute NaCl solutions, the solute completely dissociates into Na+and Clˉ, doubling the number of solute particles, and thus i = 2.
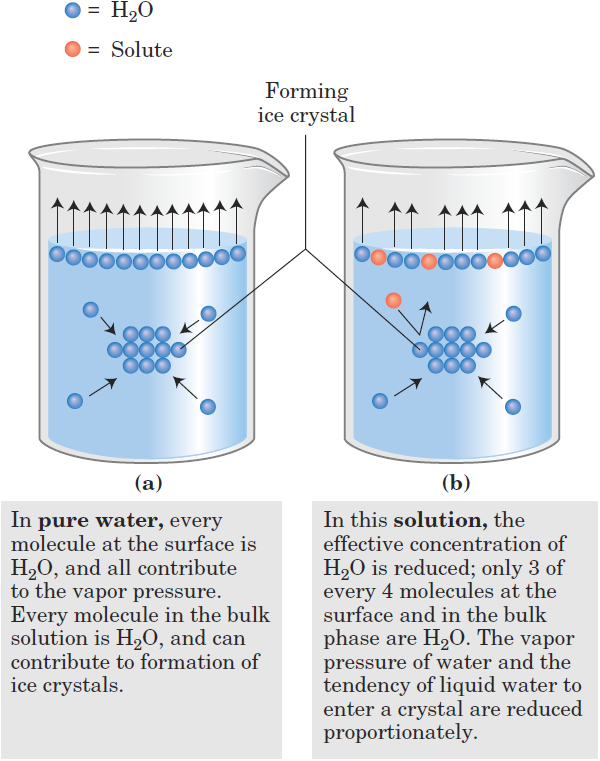
FIGURE 1.1 Solutes alter the colligative properties of aqueous solutions. (a) At 101 kPa (1 atm) pressure, pure water boils at 100 0C and freezes at 0 0C. (b) The presence of solute molecules reduce the probability of a water molecule leaving the solution and entering the gas phase, thereby reducing the vapor pressure of the solution and increasing the boiling point. Similarly, the probability of a water molecule colliding with and joining a forming ice crystal is reduced when some of the molecules colliding with the crystal are solute, not water, molecules. The effect is depression of the freezing point.
For nonionizing solutes, i is always 1. For solutions of several (n) solutes, is the sum of the contributions of each species:
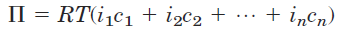



|
|
|
|
"عادة ليلية" قد تكون المفتاح للوقاية من الخرف
|
|
|
|
|
|
|
ممتص الصدمات: طريقة عمله وأهميته وأبرز علامات تلفه
|
|
|
|
|
|
|
المجمع العلمي للقرآن الكريم يقيم جلسة حوارية لطلبة جامعة الكوفة
|
|
|