


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 16-12-2015
التاريخ: 28-4-2020
التاريخ: 7-4-2016
التاريخ: 7-4-2016
|
من يقوم بماذا لمصلحة من (السالبية الكهربائية)
(ما أعنف أثر هذا الفعل الشنيع عليه! لقد اندفع عبر غياهب عقله وبددها، لقد سلط الضوء على أحد جوانبه وألقى بالغمام على الآخر، لقد تفاعل مع روحه ... كما تتفاعل عوامل كيميائية معينة مع أحد المخاليط المعكرة مرسبا أحد العناصر ومنتجا محلولا صافيا من الآخر).
فيكتور هوجو (البؤساء 1860)
لا يعني المحلول (الشفاف( للكيميائي ذلك المحلول الذي لا لون له، لكنه يعنى المحلول الذي لا يحوي مواد صلبة عالقة به، فالتفاعل الترسيبي هو التفاعل الذي يختلط فيه محلولان شفافان مكونين مادة صلبة في المحلول. ترى لماذا يقرر محلولان شفافان أن يكونا مادة صلبة؟ تأمل معي الموقف الاجتماعي التشبيهي الآتي: انضم إلى حفل اثنان من المدعوين مثلاً لأنه من الجيد أن يشترك الأفراد في المواصلات ما دام الطريق واحداً، إلا أنهما ينفصلان في أثناء السهرة ويتواصل كل منهما مع أناس آخرين، وإذا وجد كل واحد منهما في الغرفة التي تعج بالناس، شخصا ما وأقام معه صلة وثيقة خاصة فقد يترك الحفل مع ذلك الشخص وقد يرتبطا معاً بكل توفيق. وكذلك في الكأس التي تعج بالأيونات، إذا وجد أيون أيونا آخر وكون معه رابطة قوية سينتج عن ذلك مادة صلبة، وعندما يرتبط أيونان ليكونان مادة صلبة، هذه المادة الصلبة تسمى (ملحا).
وللأسف قد يتطور هذا التشبيه الاجتماعي! حتى الأنواع الكيميائية المترابطة يمكن إغواؤها لتغير شريكها إلى حين: ارتد نظارتك الواقية مرة أخرى دقيقة وأذب ملعقة شاي (٥مليلتر) من حجر الشبة في نصف كوب (١٢٠مليلترا) ماء ثم أضف أقل من ربع ملعقة (١مليلتر) من النشادر وقلبها. تشاهد راسبا أبيض غليظ القوام. أضف أربع قطرات من المحلول المخفض لقلوية ماء حوض الأسماك ثم قلب جيدا. استمر في إضافة قطرات المحلول إلى أن يذوب الراسب الأبيض ويصبح محلولا شفافا مرة أخرى. تعتبر النشادر مادة قاعدية والمحلول المخفض للقلوية حامضا (تذكر أنه كلما انخفضت (PH) زادت حامضية المحلول). وسواء تكون محلول أم لا فإن هذا يتوقف على محيط الملح.
ويمكن أن يتطور التشبيه الاجتماعي مرة أخرى. ويعتبر الانحلال عكس الترسب، وفي حالة الغياب التام للماء تعتبر كل وحدات الملح صلبة، إلا أن الماء من الممكن أن يكون مدمرا للأسرة؟ فيمكن لجزيئات الماء أن تندس بين الأيونات. وملح الطعام، كلوريد الصوديوم، صلب بشكل كاف في عبوته قبل استخدامه في الطعام، لكن عندما يكون مبللا تشق جزيئات الماء طريقها بين أيونات الكلوريد وأيونات الصوديوم وتفصلهما عن بعضهما. لماذا إذن لا يندس الماء بنفسه بين أيونات الكربونات وأيونات النحاس في كربونات النحاس غير المذابة في التجربة السابقة؟ الأمر يقتصر على مجرد اعتبارها صفقة: بمعنى أنه إذا كان الانفصال أكثر كلفة من الفوائد المحتملة، فيظل الاتحاد قائماً، إذا لم يكن كذلك، فلنر ماذا سيحدث.
لفهم العوامل المتضمنة في تحليل الكلفة والفائدة في ذوبان الملح، نحتاج أن نسترجع مرة أخرى فكرة قدمناها من قبل: لقد ذكرنا أن الذرات تميل لأن تكتسب أو تفقد إلكترونات، وإذا قامت بهذا الصنيع، اقتربت من الحالة المثلى

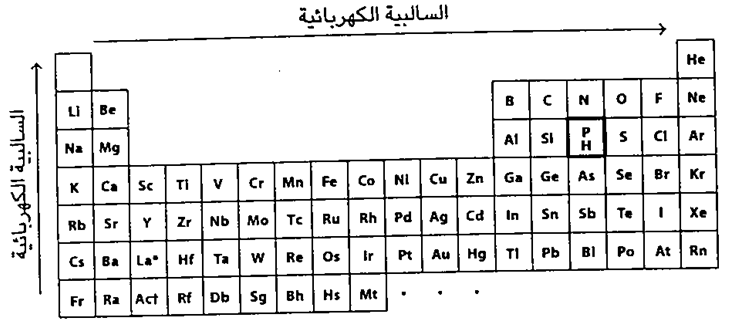
شكل ١: الجدول الدوري موضحا اتجاهات السالبية الكهربائية، فتميل الإلكترونات لأن تصبح أكثر سالبية كهربائية كلما اتجهنا نحو اليمين وإلى قمة الجدول. ويعتبر الفلور أكثر العناصر سالبية كهربائية. ولا تدخل العناصر النبيلة ضمن نطاق الساليبة الكهربائية لأنها لا تدخل عادة في تفاعلات كيميائية.
لطبقات مشبعة، كما ذكرنا أيضا أنه عندما تقوم اللافلزات بعملية الاتحاد، فإنها تميل لأن تشارك بالإلكترونات على غير المعتاد لتشبع حاجاتها. وكما اتضح أن بعض العناصر لديها القدرة على جذب الإلكترونات بطريقة أقوى من غيرها، ويطلق على القدرة على جذب الإلكترونات ( السالبية الكهربائية ) وتعتمد السالبية الكهربائية على موقع العناصر في الجدول الدوري.
ومن بين جميع العناصر في الجدول الدوري، يعتبر عنصر الفلور أكثر العناصر سالبية كهربائية كما هو موضح في الشكل رقم ١ مما يرجح أن الفلور هو العنصر الذي يأخذ نصيب الأسد من بين بقية العناصر. وتتكالب في مركبات الفلور الإلكترونات حول الفلور أكثر من أي عنصر آخر. وفي الجدول الدوري كلما كان العنصر أكثر قربا من الفلور زادت سالبيته الكهربائية؟ لأن السالبية الكهربائية هي قياس مدى جاذبية العناصر للإلكترونات عندما تكون في اتحاد مع عنصر آخر، ولا ينطبق هذا مع العناصر النبيلة بدءا من الهليوم He وحتى الرادون Rn، فهذه العائلة لا تكون مركبات تحت الظروف العادية.
أليس هذا جيدا؟ فالجدول الدوري لا يخبرنا عن عدد البروتونات في النواة وعدد الإلكترونات في الذرة المتعادلة للعنصر وبعض الشي، عن تفاعلية نشاط العنصر من خلال العائلة التي ينتمي إليها فحسب، بل يمكن أن يعمل الجدول الدوري أيضا كوسيلة للتنبؤ بالسالبية الكهربائية النسبية، ويمكننا الحصول على تفسير لهذه المطابقة عن طريق فهم التركيب الذري: فلا تحوز العناصر الواقعة كلما اتجهنا نحو قمة الجدول الكثير من الطبقات تامة الامتلاء، فيمكن للإلكترون الجديد الشعور بالمزيد من الانجذاب نحو النوى الموجبة الشحنة دون وجود إلكترونات أخرى تعوق طريقه. يستمتع الفلور بحاله كأكثر العناصر سالبية كهربائية في الجدول الدوري ومرجع ذلك سببان على الأقل؟ الأول: أن الفلور لديه طبقة واحدة مشبعة، وثانيا: أنه هو العنصر الوحيد - دون كل عناصر الصف الثاني غير المشبعة - الذي يتمتع بأكبر شحنة نووية؟ فهو يحوي تسعة بروتونات. والعنصر الوحيد في الصف الثاني الذي له شحنة نووية أكبر هو النيون وهو يحوي كل الإلكترونات التي يحتاجها. ماذا عن الهيدروجين إذن؟ لا يمتلك الهيدروجين طبقة مشبعة. وبإضافة إلكترون واحد للهيدروجين سيصبح معرضا تماماً للنويات المشحونة بشحنات موجبة. لماذا لا يتمتع الهيدروجين بسالبية إلكترونية عالية؟ لأن الأمر يتوقف على الحجم حتى في المستوى الذري.
وعادة تميل الذرات إلى أن تكتسب حجمّا أكبر وأنت تتحرك إلى أسفل في الجدول الدوري لأن العناصر لديها الكثير من الإلكترونات وهذه الإلكترونات تشبع الطبقات، ولا يتمتع الهيدروجين بنفس القدر من السالبية الكهربائية مثل الفلور لأنه لم يكتسب أية طبقة مشبعة مثل الفلور إلى جانب أنه غاية في الصفر على أن يوفر بارتياح شحنة سالبة كبيرة. ويشبه الفرق بين أيون الفلور الذي يحمل شحنة سالبة وأيون الهيدروجين الذي يحمل شحنة سالبة الفرق بين فرد يحمل حقيبة بها عشرون رطلآ من طعام الكلب أو يحمل قنبلة وزنها عشرون رطلا؟ فطعام الكلب يسهل حمله لأن الوزن موزع على منطقة أكبر، أما القنبلة فيصعب حملها لأن الوزن مركز في نقطة واحدة. بالمثل عندما تحمل ذرة الهيدروجين شحنة سالبة، تتجمع كل هذه الشحنة في حجم غاية في الصغر، وعندما تتداخل كافة العناصر المتشابكة، يتمتع الهيدروجين بسالبية كهربائية مشابهة لتلك التي للفسفور كما هو موضح في الشكل٢ .
إذن ما هي نتيجة كل هذه الانجذابات ومعاًيضات الإلكترونات بين العناصر في المركب؟ النتيجة هي شيء يطلق عليه )الاستقطاب الجزيئي(.
ويعتبر مفهوم الاستقطاب مفهوماً شائعاً، فالبطاريات لها أقطاب موجبة وأخرى سالبة، وللمغناطيس قطب شمالي وقطب جنوبي، وعندما تفضل

الشكل ٢ : أن للهيدروجين سالبية كهربائية مشابهة لتلك التي للفسفور.
الإلكترونات أن تقترن بأحد أطراف الجزيء حيث توجد العناصر ذات السالبية الإلكترونية الأكبر، يكون للجزيء قطب موجب وقطب سالب ومن ثم فهو له قطبية. ويطلق على الجزيء الذي له قطب موجب آخر وقطب سالب آخر(ثنائي الأقطاب( لأن له قطبين.
تتصرف الجزيئات القطبية إلى حد ما مثلما يتصرف القضيب المغناطيسي، فالطرف الموجب لجزيء أحادي الأقطاب يتحد مع الطرف السالب لجزيء آخر، مثلما ينجذب القطب الشمالي لقضيب مغناطيسي مع القطب الجنوبي لقضيب آخر. فالماء (H2O) الذي يأخذ شكل حرفV وبه يكون الأوكسجين في المنتصف وذرتا الهيدروجين عند طرف حرف V هو جزيء قطبي. ويعتبر الأوكسجين أكثر سالبية كهربائية من الهيدروجين فتنجذب الإلكترونات نحو طرف الأوكسجين وبعيدا عن الهيدروجين، وتنجذب أطراف الأوكسجين في عدة جزيئات ماء إلى أيون مشحونة بشحنة موجبة مكونة قفصا حوله وحامية إياه بمعزل عن شريكه المشحون بشحنة سالبة. بالمثل تصطف أطراف الهيدروجين المشحونة بشحنة موجبة في عدة جزيئات ماء مع الأيونات المشحونة بشحنات سالبة مكونة حولها قفصا مماثلا. وهذا الوضع ممثل في شكل ٣ .
تميل جزيئات الماء إلى أن تبني أقفاصا حول الأيونات لأن هذا يمثل موقفا أكثر استرخاء لها. ومثلما تتطلب بعض الطاقة لتعزل قوى المغناطيس التي ينجذب بعضها لبعض، فإننا نحتاج إلى الطاقة لنفصل الجزيئات التي ينجذب
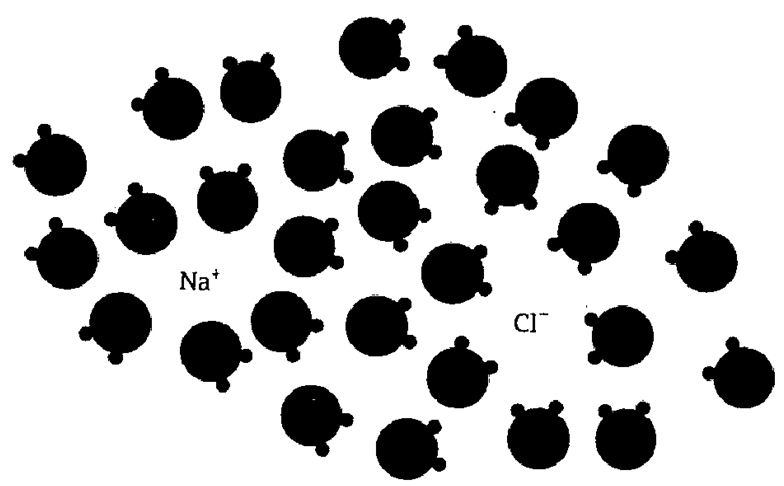
 شكل ٣ : جزيئات الماء التي تعزل أيون الصوديوم وأيون الكلور عن طريق تكوين أقفاص المذيب حول الأيونات.
شكل ٣ : جزيئات الماء التي تعزل أيون الصوديوم وأيون الكلور عن طريق تكوين أقفاص المذيب حول الأيونات.
بعضها لبعض أو إلى أيون واحد. وإتاحة الفرصة لجزيئات الماء أن تكون أقفاصا حول الأيونات، يسمح لها بالاسترخاء وإطلاق طاقة.
إلا أن هناك حاجة إلى الطاقة لتفتيت الملح أيضا، ومن ثم تحدث المعاًيضة. وإذا كان تكلفة تفتيت الملح أكبر من الفوائد المحققة من خلال السماح لجزيئات الماء بالاسترخاء في أقفاص، عندئذ يترسب الملح في المحلول أو لا يذوب أصلا. وإذا كانت تكلفة تفتيت الملح أقل من الفوائد المحققة عن طريق السماح لجزيئات الماء بالاسترخاء في شكل أقفاص، فإن الملح يبقى في المحلول أو يذوب.
وبزيارة أخرى للجدول الدوري يمكننا أن نخلص إلى أن الفلزات التي تقع في العمود الأول (الليثيوم Li)، والصوديومNa، والبوتاسيوم K، وهكذا) تميل إلى أن تكون أيونات مشحونة بشحنة موجبة واحدة لأن فقد إلكترون واحد سيمنحها طبقة خارجية مشبعة تماما. وغالبا ما تكون الأملاح المشتقة من تلك الآيونات الموجبة قابلة للذوبان حيث إن جذب شحنة واحدة موجبة يعتبر أمرا ضعيفا نسبيا. قارن قضيب المغناطيس المقترح في Sقائمة المشتريات والمحاليلR بالقضيب المغناطيسي الذي يوجد في الثلاجات. تمتلك الأيونات الموجبة المتكونة من عناصر العمود الأول جاذبية ضعيفة نسبيا للأيونات السالبة التي تشبه القضيب المغناطيسي في الثلاجة أكثر من القضيب المغناطيسي العادي.
من ناحية أخرى، تميل عناصر العمود الثاني إلى فقد إلكترونين عندما تكون أيونات، ومن ثم تكون لديها شحنة موجبة ثنائية. ويكون لهذه الأيونات قدرة أكبر على جذب الأيونات المشحونة بشحنة سالبة، وهي تميل لأن تكون مركبات تزيد قابليتها لعدم الذوبان عن نظيراتها في العمود الأول، لكن فيما وراء هذه الملاحظات الأساسية نجد أن العوامل المحددة لقابلية الأملاح لتكوين اتحادات دائمة، تكون معقدة تماما مثل الأقران من البشر، إذ يلعب الحجم والشكل والمرونة دور أيضاً. وحتى عندما تعنون هذه الاعتبارات لملح ما على أنه قابل أو غير قابل للذوبان، نجد أن المقدار الفعلي الذي يذوب أو لا يذوب يتوقف على طبيعة المذيب، وعلى مقدار الملح في المحلول، ودرجة حرارة المحلول وPH للمحلول.
وثمة تجربة مقنعة على مدى أهمية طبيعة المحلول وهي أن تحاول أن تذيب ملء ملعقة شاي (٥مليلتر) من ملح الطعام قي كوب ( ٢٤٠ مليلتر) ماء، وحاول أن تذيب نفس الكمية من الملح في كوب من زيت الصلطة أو الزيت المعدني؟ يذوب ملح الطعام في الماء بسهولة، لكنه يترسب في الزيت كما هو دون أن يذوب. حاول أن تقلب ملح الطعام في كل منهما قبل الحكم النهائي فالتقليب يساعد الأملاح على الذوبان لأن عملية الذوبان تبدأ من سطح المادة الصلبة ويساعد التقليب على تعريض المزيد من الأسطح للمحلول. لكن مهما بذلت في عملية التقليب فلن تستطيع أن تجبر كل ملح الطعام على الذوبان في محلول الزيت.
ويمكن إثبات مدى توقف الذوبان على الكمية باستخدام بيكربونات الصودا والماء. فإذا أضيف مقدار ضئيل من بيكربونات الصودا إلى كوب زجاجي (ليس من البلاستيك) شفاف يسع نحو كوبين من الماء، ينبغي أن يذوب هذا المقدار الضئيل. في حقيقة الأمر، ينبغي أن يذوب ما يقرب من عشرة أو خمسة عشر مقدار ضئيل كامل من بيكربونات الصودا، لكن عند نقطة محددة تبدأ المعاًدير المضافة في تحويل المحلول غائماً، وفي نهاية الأمر تترسب المعاًدير المضافة في القاع حتى مع التقليب. ولإثبات تأثير درجة الحرارة على عملية الذوبان نضع المحلول في الميكروويف لمدة ثلاثين ثانية، ما يكفي فقط لجعل المحلول يصل إلى درجة حرارة شربة ساخنة لكن يمكن شربها. ينبغي أن يكون المحلول الدافئ الناتج صافيا مرة أخرى، وينببغي أن تذوب كل بيكربونات الصودا الموجودة في قاع الزجاجة عند تقليبها.
ومن الممكن مشاهدة أثر المواد الأخرى على المحلول عن طريق الطباشير، قارن الطباشير الذي هو كربونات الكالسيوم مع بيكربونات الصودا، التي هي المركب المتكون من الصوديوم والهيدروجين والكربونات. فعندما نضيف ملعقة شاي ( ٥ ملليتر) من بيكربونات الصودا إلى كوب ( ٢٤٠ مليلترا) من الماء الدافئ فإنها تذوب، وبوضع نفس الكمية من مسحوق الطباشير فإنها ستغوص إلى العمق مثل الصخرة، في حين أن الطباشير يذوب عندما يوضع في الخل، ذلك لأن الخل حامض والطباشير يتفاعل مع الحامض، وعند تعريف الطباشير نجد أنه قاعدة، لكنه القاعدة التي لا تذوب في المحاليل المتعادلة مثل المياه غير المرشحة. وفي الخل أي في الحامض تتعادل قاعدة الكربونات ويذهب الكالسيوم إلى المحلول.
لذلك يبدو أنه مع كل هذه التغيرات - طبيعة الملح، وطبيعة المحلول، وكمية الملح، ودرجة حرارة المحلول - أن كلآ من عمليتي الترسيب والذوبان معقدتان إلى حد ما، فهما لا تحدثان على الفور. ومع ذلك فسنخوض في هذه المفاهيم مرة أخرى في مواقف مختلفة عبر مسيرتنا لأن الترسيب والذوبان يدخلان في الكثير من التفاعلات الكيميائية. فعلى سبيل المثال يتكون الصدف عندما ينبعث الكالسيوم من مخلوق بحري فيختلط مع الكربونات الموجودة في الماء مكوناً كربونات الكالسيوم. وتعلل أيونات الصدف المتجمعة في قاع المحيط تكوين الطباشير أو الحجر الجيري الذي يجد طريقه إلى سبوراتنا وأرصفة شوارعنا.
وتعتبر عملية الترسيب نافعة في عملية معالجة النفايات الخطيرة، فإذا كان من الممكن ترسيب المعادن الضارة في المحاليل، فيمكن فصلها من المحاليل باعتبارها مواد صلبة تشغل حيزا من الفراغ أقل من الفضلات السائلة ومن ثم يسهل نقلها وتخزينها. ثمة نوع آخر من الترسيب لكنه مزعج، وهو تفاعلات الترسيب التي تحدث في مكان غير متوقع وهو جسم الإنسان: فالنقرس يحدث بسبب ترسيبات حامض البوليك المتجمعة في المفاصل. وحصوات المرارة والكل ما هي إلا رواسب، إلا أن هذه الرواسب المرضية ليست بالأمر الطبيعي. فجسم الإنسان خليط قوامه سائل إلى حد ما حيث إن جوهر الحياة هو القدرة على التغير استجابة للبيئة المحيطة، من ثم يجب أن تكون معظم مواد الجسم قادرة على الحركة وجاهزة لذلك، ويمكن اكتمال هذه القدرة على الحركة عن طريق الماء، نظراً لقدرة الماء المرتفعة جدا على حفظ المواد في المحلول. يستطيع جسم الإنسان أن يتحمل فترة طويلة بدون غذاء أكثر من تحمله لغياب الماء، وبدون الماء يصبح كل من الجسم والمخ في حالة كسل وتراخ. وتتأثر الكثير من الحالات وكذلك الأمزجة بشكل فعلى إذا لم يعدل أمر الماء بزيادة المقدار اليومي من الماء. في كثير من الأحيان عندما يتعلق الأمر بالصحة يكون الماء هو الحل.
ويعتبر زبد الصابون نوعا أخر من الترسيب الشائع. ويطفو زبد الصابون عادة على الماء بدلا من أن يترسب، من ثم لا ينظر إليه عادة على أنه راسب لكن هذا مسألة دلالات لفظية. يتكون زبد الصابون في البانيو عندما يختلط الصابون بالماء العسر، وهو الماء الذي يحوي أيونات كالسيوم وماغنسيوم. يطلق على الماء الذي يحوي أيونات كالسيوم وماغنسيوم )عسر) لأن هذه الأيونات تميل إلى أن تكون رواسب (التي هي صخور صفيرة) غير قابلة للذوبان في الماء.



|
|
|
|
دخلت غرفة فنسيت ماذا تريد من داخلها.. خبير يفسر الحالة
|
|
|
|
|
|
|
ثورة طبية.. ابتكار أصغر جهاز لتنظيم ضربات القلب في العالم
|
|
|
|
|
|
|
العتبة العباسية المقدسة تستعد لإطلاق الحفل المركزي لتخرج طلبة الجامعات العراقية
|
|
|