


 النبات
النبات
 الحيوان
الحيوان
 الأحياء المجهرية
الأحياء المجهرية
 علم الأمراض
علم الأمراض
 التقانة الإحيائية
التقانة الإحيائية
 التقنية الحيوية المكروبية
التقنية الحيوية المكروبية
 التقنية الحياتية النانوية
التقنية الحياتية النانوية
 علم الأجنة
علم الأجنة
 الأحياء الجزيئي
الأحياء الجزيئي
 علم وظائف الأعضاء
علم وظائف الأعضاء
 الغدد
الغدد
 المضادات الحيوية
المضادات الحيوية|
Read More
Date: 2025-04-12
Date: 8-11-2015
Date: 8-12-2020
|
Antibodies are capable of binding a wide variety of antigens, including macromolecules and small chemicals. The reason for this is that the antigen- binding CDR loops of antibody molecules can either come together to form clefts capable of accommodating small molecules or form more extended surfaces capable of accommodating larger molecules (Fig. 1). Antibodies bind to antigens by reversible, noncovalent interactions, including hydrogen bonds, hydrophobic interactions, and charge-based interactions. The parts of antigens that are recognized by antibodies are called epitopes, or determinants. Some epitopes of protein antigens may be a contiguous stretch of amino acids in the primary structure of the protein; these are called linear epitopes. Sometimes, amino acids that are not next to one another in the primary structure may be brought into proximity when the protein folds, forming a distinct shape that is recognized by an antibody; such determinants are called conformational epitopes.
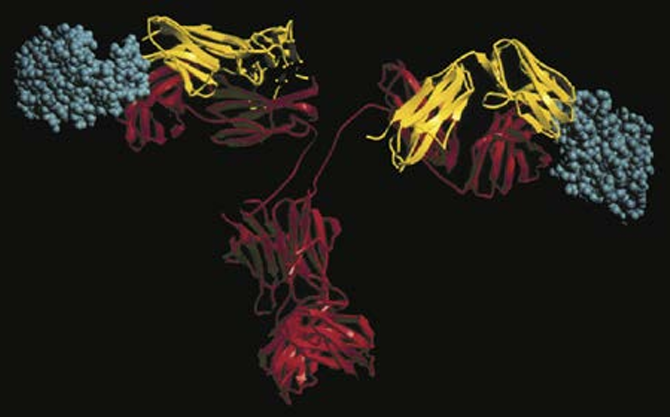
Fig.1 Binding of an antigen by an antibody. This model of a protein antigen bound to an antibody molecule shows how the antigen-binding site can accommodate soluble macromolecules in their native (folded) conformation. The heavy chains of the antibody are red, the light chains are yellow, and the anti gens are blue. (Courtesy Dr. Dan Vaughn, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY.)
The strength with which one antigen-binding site of an antibody binds to one epitope of an antigen is called the affinity of the interaction. Affinity often is expressed as the dissociation constant (Kd), which is the molar concentration of an antigen required to occupy half the available antibody molecules in a solution; the lower the Kd, the higher the affinity. Most antibodies produced in a primary immune response have a Kd in the range of 10−6 to 10−9 M, but with repeated stimulation (e.g., in a secondary immune response), the affinity increases to a Kd of 10−8 to 10−11 M. This increase in antigen-binding strength is called affinity maturation .
Each IgG, IgD, and IgE antibody molecule has two antigen-binding sites. Secreted IgA is a dimer of two linked IgA molecules and therefore has four antigen- binding sites, and secreted IgM is a pentamer, with 10 antigen-binding sites. Therefore, each antibody molecule can bind 2 to 10 epitopes of an antigen, or epitopes on two or more neighboring antigens. The total strength of binding is much greater than the affinity of a single antigen-antibody bond and is called the avidity of the interaction. Antibodies produced against one antigen may bind other, structurally similar antigens. Such binding to similar epitopes is called a cross-reaction.
In B lymphocytes, membrane-bound Ig molecules are noncovalently associated with two other proteins, called Igα and Igβ; these latter proteins combine with the membrane Ig to make up the BCR complex. When the BCR recognizes antigen, Igα and Igβ transmit signals to the interior of the B cell that initiate the process of B cell activation.

|
|
|
|
للعاملين في الليل.. حيلة صحية تجنبكم خطر هذا النوع من العمل
|
|
|
|
|
|
|
"ناسا" تحتفي برائد الفضاء السوفياتي يوري غاغارين
|
|
|
|
|
|
|
نحو شراكة وطنية متكاملة.. الأمين العام للعتبة الحسينية يبحث مع وكيل وزارة الخارجية آفاق التعاون المؤسسي
|
|
|