


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 10-3-2018
التاريخ: 3-4-2017
التاريخ: 22-9-2020
التاريخ: 2024-02-28
|
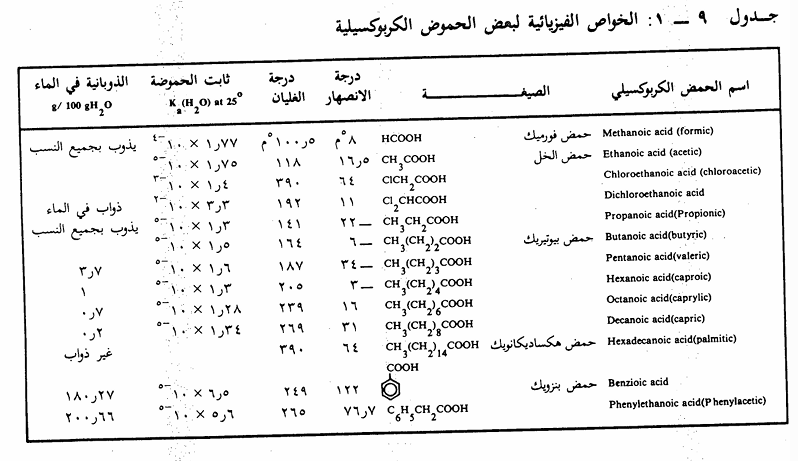
الحموض الأليفاتية الدنيا مواد سائلة لا لون لها أو لها درجات انصهار منخفضة ولكنها لا تزال أعلى من درجات غليان معظم المركبات العضوية ذات الأوزان الجزيئية المقاربة. فدرجة غليان الحمض الكربوكسيلي أعلى بكثير من درجة غليان المركب الألكاني أو هاليد الألكيل التي تقابلها في الأوزان الجزيئية. تشبه الكحولات في قلة قابليتها للتطاير إلا أن لها درجات غليان أعلى بسبب ظاهرة التجمع الجزيئي عن طريق الروابط الهيدروجينية الجسرية التي تحدث بترابط مجموعة كربوكسيل مع مجموعة كربوكسيلية بجزىء آخر.

تذوب الحموض الأليفاتية البسيطة في الماء نظراً للقطبية العالية التي تتمتع بها مجموعة الكربوكسيل. وتقل خاصية الذوبان هذه بارتفاع الوزن الجزيئي. أما الحموض الأروماتية فهي قليلة الذوبان في الماء البارد، فمثلاً يذوب حمض بنزويك الماء الساخن إلى حد ما، وهذه الخاصية صفة مميزة لكثير من الحموض الأروماتية فهي معتدلة الذوبان عادة في الماء الساخن .
ثابت الحموضة : توجد الحموض الكربوكسيلية في حالة اتزان مع أيون الكربوكسيلات (القاعدة المرافقة) وأيون الهيدروجين البروتون في المحاليل المائية.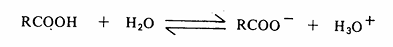 ويمكن حساب ثابت الحموضة (Ka) من العلاقة التالية:
ويمكن حساب ثابت الحموضة (Ka) من العلاقة التالية:

ولكل حمض كربوكسيلي ثابت حموضة Ka مميز يقيس قوة حموضته حيث أنه كلما زادت قيمة Kaلمركب ما كلما زادت حمضيته والحموض الكربوكسيلية حموض ضعيفة إلا أنها أقوى حموضة من الكحولات والفينولات نظراً لثبات التأرجح الخاص بأيون الكربوكسيلات (القاعدة المرافقة).

فانتشار الشحنة على ذرتي الأكسجين يزيد من ثبات القاعدة المرافقة وهذا يسهل فقدان أيون الهيدروجين من مجموعة الكربوكسيل. وكلا شكلي التأرجح أعلاه لهما طاقة متساوية ويؤديان إلى إسهام متساو من هجين التأرجح أي أن. الشحنة السالبة لا موضعية delocalized بين كلتي ذرتي الأكسجين وتخص كل ذرة أكسجين شحنة جزئية سالبة سبق وأن رأينا أن المجموعات الألكيلية هي سبب الاختلاف البسيط في حمضية كل من الماء والكحولات وعلى ضوء ذلك فإن تنوع المجموعات البديلة سيغير من حمضية المادة. إن أبسط حمض كربوكسيلي هو في الحمض. حتماً حمض فورميك، الذي فيه ذرة هيدروجين مرتبطة مباشرة بذرة كربون مجموعة الكربوكسيل، والفرد الثاني من هذه الطائفة هو حمض الخل (حمض أسيتيك) وفيه مجموعة الميثل مرتبطة بالمجموعة الكربوكسيلية ومجموعة الميثل هي مجموعة مانحة للالكترونات بالمقارنة لذرة الهيدروجين. وتأثير تنفير الالكترونات لهذه المجموعة يضعف حمضية حمض الخل، ويرجع ذلك إلى أن المجموعات الألكيلية (مجموعات مانحة ( سوف تقلل من ثبات القاعدة المرافقة مما يقلل تركيزها وبالتالي يكون تركيز البروتون قليلا وهذا يعني أن المركب أقل حمضية.


أقل ثبات )بسبب مجموعة CH3 المانحة الكترونات للأيون المتخم بالإلكترونات) «أقل تركيز» (وهذا يعني أن تركيز +H أقل)
ولكن حلقة البنزين أكثر سالبية كهربية من مجموعة الألكيل لأنها تتألف من ذرات كربون من النوع sp2 ولهذا فإن حمض بنزويك أقوى حموضة من حمض الخل بسبب التأثير التحريضي لمجموعة الفينل الساحبة. كما أن استبدال ذرة هيدروجين أو أكثر من حلقة البنزين بمجموعة مانحة للالكترونات يؤدي إلى ضعف الحموضة في المركبات الناتجة من هذا الاستبدال، ويعزى ذلك لنفس الأسباب السابقة وهو مدى ثبات القاعدة المرافقة، كما يتضح من الأمثلة التالية:

والعكس فإن إدخال مجموعات ساحبة للالكترونات بدلاً من المجموعات الألكيلية فإن هذا يؤدي إلى ازدياد في قوة الحموضة للمركبات الناتجة بسبب التأثير التحريضي لهذه المجموعات وبقدر ما يزداد عدد هذه المجموعات فإن صدى هذا التأثير يكون أقوى كما يتضح من الأمثلة التالية :




|
|
|
|
التوتر والسرطان.. علماء يحذرون من "صلة خطيرة"
|
|
|
|
|
|
|
مرآة السيارة: مدى دقة عكسها للصورة الصحيحة
|
|
|
|
|
|
|
نحو شراكة وطنية متكاملة.. الأمين العام للعتبة الحسينية يبحث مع وكيل وزارة الخارجية آفاق التعاون المؤسسي
|
|
|