


 الفيزياء الكلاسيكية
الفيزياء الكلاسيكية
 الكهربائية والمغناطيسية
الكهربائية والمغناطيسية
 علم البصريات
علم البصريات
 الفيزياء الحديثة
الفيزياء الحديثة
 النظرية النسبية
النظرية النسبية
 الفيزياء النووية
الفيزياء النووية
 فيزياء الحالة الصلبة
فيزياء الحالة الصلبة
 الليزر
الليزر
 علم الفلك
علم الفلك
 المجموعة الشمسية
المجموعة الشمسية
 الطاقة البديلة
الطاقة البديلة
 الفيزياء والعلوم الأخرى
الفيزياء والعلوم الأخرى
 مواضيع عامة في الفيزياء
مواضيع عامة في الفيزياء|
أقرأ أيضاً
التاريخ: 2023-05-17
التاريخ: 30-6-2016
التاريخ: 2024-10-01
التاريخ: 2023-05-27
|
يُعد القانون الثاني للديناميكا الحرارية قانونًا أساسيًا تمامًا لتطبيق الديناميكا الحرارية في مجال الكيمياء، والذي عادةً ما يتخذ شكلا متخفيًا، ولكن دائمًا ما يكون قابعا وراء النقاشات الدائرة حول التفاعلات الكيميائية وتطبيقاتها في علم الأحياء والتكنولوجيا على حد سواء.
يعين القانون الأول حدود التغيرات المحتملة (فهي يجب أن تحافظ على إجمالي كمية الطاقة، ولكن تتيح لها الانتقال من مكان إلى آخر أو التحول إلى حرارة أو شغل). ومن بين تلك التغيرات المحتملة يحدد القانون الثاني التغيرات التي قد تحدث بشكل تلقائي. والمعنى الاعتيادي لـ «التلقائية» هو أنها تحدث «بدون وساطة خارجية»؛ وهذا يعني في الكيمياء الفيزيائية، بدون الاضطرار إلى بذل «شغل» لإحداث التغير. وهذا لا يعني السرعة، كما تعني الكلمة ضمنًا أحيانًا في إطار الكلام العادي. قد تكون التغيرات التلقائية بطيئة جدا: فالاسم يشير ببساطة إلى أن بها «نزعة» لأن تحدث بدون تدخل. ومن منطلق هذا المعنى، يُعد تحول الألماس إلى جرافيت أمرًا تلقائيًّا؛ إلا أنه يحدث ببطء شديد لدرجة أنه يمكن التغاضي عن التغير من الناحية العملية. فتمدد الغاز في فراغ هو عملية تلقائية وسريعة على حد سواء. أما انضغاطه إلى حجم أصغر فهو عملية غير تلقائية: يجب علينا أن نبذل شغلًا ونضغط على مكبس ما لإحداث هذا التغير. باختصار، يحدد القانون الأول التغيرات المحتملة؛ ويحدد القانون الثاني أي هذه التغيرات المحتملة هي تغيرات تلقائية. يحدد القانون الثاني التغيرات التلقائية باعتبارها تغيرات تصاحبها زيادة في الإنتروبي. والإنتروبي، الذي يُرمز له بـ S، هو مقياس لجودة الطاقة: فالإنتروبي القليل يعني مستوى عاليًا من الجودة بمعنى سأشرحه؛ أما الإنتروبي العالي، فيعني مستوى متدنيًا من الجودة والمقابل الإنجليزي لمصطلح إنتروبي entropy مشتق من العبارة اليونانية التي تعني «التحول إلى الداخل»، وتعطي انطباعًا بالتغيرات التي تحدث داخل نظام ما. ومن ثم، فإن الزيادة في الإنتروبي توازي الانخفاض في جودة الطاقة، فهي مثلا تتبدد على نطاق أوسع وتقل فائدتها في بذل الشغل.
والإنتروبي مرتبط عادةً بقياس الفوضى أو الاضطراب، مثل تبدد الطاقة أو انتشار غاز ما (انظر شكل 2–2). وهذا تفسير مفيد جدًّا يجب وضعه في الاعتبار. كان أول من اقترح التعبير الكمي لحساب القيمة العددية للتغير في الإنتروبي هو الفيزيائي الألماني رودولف كلاوزيوس (1822–1888) في عام 1854: تقتضي صيغته أنه من أجل حساب التغير في الإنتروبي يجب علينا أن نلاحظ بدقة الطاقة التي تنتقل كحرارة أثناء التغير ونقسمها على درجة الحرارة المطلقة التي يحدث عندها التغير. وبالتالي، إذا أُدخل 100 جول من الحرارة إلى دورق من الماء عند درجة حرارة 20 درجة مئوية (293 كلفن)، يزداد إنتروبي الماء بمقدار 0.34 جول لكل كلفن. وقد طور نهج مختلف جدا ولكنه تكميلي وثاقب بصورة بالغة على يد لودفيج بولتزمان.
لقد استعان علماء الكيمياء الفيزيائية بصيغة كلاوزيوس لتجميع جداول قيم الإنتروبي الخاصة بمجموعة كبيرة من المواد (حيث استعانوا أيضًا بالقانون الثالث للديناميكا الحرارية، والتي يمكن الاستعانة بها لتقييم التغير في الإنتروبي عندما تتغير المواد المتفاعلة ذات إنتروبي معين إلى نواتج ذات إنتروبي مختلف.
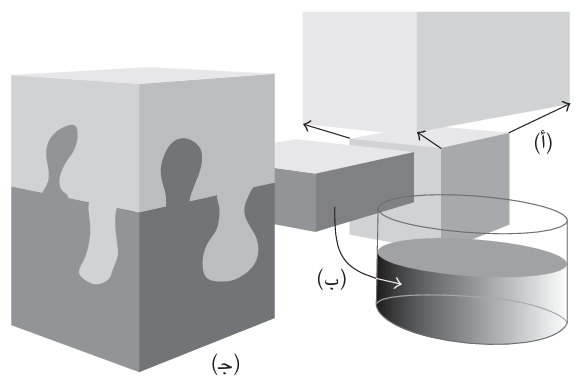
شكل 2–2: الإنتروبي هو مقياس لـ «الاضطراب». ومن ثَم، فهي تزداد (أ) عندما ينتشر غاز ما، و (ب) عندما تنصهر مادة صلبة ، و (ج) عندما تختلط مادتان.
وهذه معلومة ضرورية لتقرير ما إذا كان التفاعل تلقائيا عند أية درجة حرارة معينة (تذكر أنه ليس بالضرورة سريعًا وإنما تلقائيًّا فحسب. وهذا مثال آخر للأهمية القصوى لاعتماد الكيميائيين على إنجازات الفيزيائيين، الفيزيائي كلاوزيوس في هذه الحالة، لفهم السبب وراء «حدوث» تفاعل كيميائي ما دون الآخر، وهذا أمر أساسي لعلم الكيمياء ويقع في نطاق تخصص الكيمياء الفيزيائية، الذي يعد حلقة الوصل بين الفيزياء والكيمياء.



|
|
|
|
دراسة: حفنة من الجوز يوميا تحميك من سرطان القولون
|
|
|
|
|
|
|
تنشيط أول مفاعل ملح منصهر يستعمل الثوريوم في العالم.. سباق "الأرنب والسلحفاة"
|
|
|
|
|
|
|
لتعزيز التواصل مع الزائرات الأجنبيات : العتبة العلويّة المقدّسة تُطلق دورة لتعليم اللغة الإنجليزية لخادمات القسم النسويّ
|
|
|