علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
قلوية المياه Water alkalinity
المؤلف:
د. حسان صديق / د. نائل يسري
المصدر:
كيمياء البيئة
الجزء والصفحة:
ص 174-175
2023-10-25
2655
تعرف قلوية وسط مائي بكمية شوارد + H( البروتون) القادرة على استيعابها ليصبح الوسط معتدلاً. يعد قياس القلوية هام في دراسة كل من معالجة المياه وكيمياء وحيوية المياه الطبيعية حيث يجب قياس القلوية بشكل دوري لحساب كمية المواد الكيميائية اللازم إضافتها لمعالجة المياه ففي المياه ذات القلوية مرتفعة القيمة، تكون عادة قيمة pH مرتفعة وتحتوي على مستويات عالية من الأملاح المنحلة. بذلك تلعب هذه القلوية دور محلول واقي تجاه الحموضة أو خازن المركبات الكربون اللاعضوية، التي تستخدم كغذاء من قبل الأشنيات وبعض الأحياء الأخرى، أي تعبر القلوية عن مقياس الخصوبة المياه.
تكون الجزيئات المسؤولة عن القلوية ، عادة، في المياه الطبيعية غير الملوثة، هي البيكربونات - HCO3، والكربونات CO3 -2 والهيدروكسيل - OH
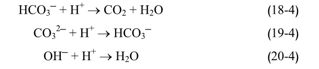
كما يمكن أن يساهم وجود بعض الجزيئات الأخرى، في قلوية المياه، كالأمونيا، الأسس المرافقة لحمض الفوسفور، حمض البور، أو بعض الحموض العضوية. تقاس القلوية بشكل عام بالمعايرة بحمض عياري بوجود مشعر الفينول فتالئين عند نقطة تحول 8.3 pH=، وتكون عندها شوارد البيكربونات هي المسيطرة. أما القلوية الكلية فتعاير بحمض عياري وبوجود مشعر الميتيل أورانج ، عند نقطة تحول 4.3= pH حيث تكون عندها مجمل كمية الكربونات والبيكربونات قد تحولت إلى الشكل المسيطر، ثاني أوكسيد الكربون. بذلك فإنه في الأوساط الحامضية ، 7 > pH، ينقص تركيز شوارد الهيدروجين من قيمة القلوية، وفي هذه الحالة يجب طرح قيمتها من قيمة القلوية الكلية:
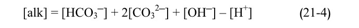
لا بد من التمييز هنا بين الأساسية المرتفعة أي قيمة pH مرتفعة، وبين القلوية المرتفعة وهي سعة استيعاب شوارد الهيدروجين .H+ حيث يدعى الـ pH بمعامل الشدة، وتدعى القلوية بمعامل السعة لفهم الفارق بين المعاملين السابقين يمكن مقارنة محلول ماءات الصوديوم NaOH، تركيزه 3-10 x 1، مع محلول ثان من بيكربونات الصوديوم NaHCO3 تركيزه . 0.1. يعد المحلول الأول أساسي ذو 11 pH= ، ويعدل لتر واحد منه باستهلاك -3 10 مول من الحمض بينما يبلغ pH المحلول الثاني وهي أقل بكثير من pH المحلول الأول (رغم تركيزه الأعلى)، ويلزم لتعديل لتر واحد منه 0.1 مول من الحمض بذلك تكون قلوية المحلول الثاني أكبر مئة مرة من قلوية المحلول الأول برغم أن قيمة pH فيه أصغر بكثير.
من وجهة نظر بيئية هندسية، يعبر عن القلوية بالواحدة ملغ ليتر من CaCO3 وذلك انطلاقاً من تفاعل التعديل التالي:
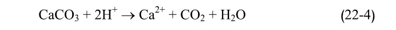
لكن هذا التعبير يعد خطأ كيميائياً، لأن كربونات الكالـسيوم تعدل بشاردتي هيدروجين، ويفضل التعبير عنها بالواحدة مكافئ ليتر من شوارد H المطلوبة للتعديل.
 الاكثر قراءة في كيمياء البيئة
الاكثر قراءة في كيمياء البيئة
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)