


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية | طرق التعبير عن تراكيز المحاليل المستخدمة في التحليل والحسابات الكيميائية المتعلقة بالتحليل الحجمي |
|
|
|
أقرأ أيضاً
التاريخ: 25-2-2018
التاريخ: 2024-02-10
التاريخ: 2024-01-23
التاريخ: 24-8-2016
|
. يمكن التعبير عن تراكيز المحاليل كما يلي :
1- العيارية : Normality
ويرمز إليها بالحرف (N) وتعرف بأنها عدد المكافئات الجرامية Number of gram equivalent من المذاب في لتر من المحلول ، وهذا يعني أن المحلول العياري لمادة ما هو اللتر الواحد من المحلول يحتوي علي وزن مكافئ واحد منها . فالمحلول العياري لهيدروكسيد الصوديوم هو المحلول الذي يحتوي اللتر الواحد منه على 40 جم من NaOH .
وتستعمل العلاقات الرياضية الآتية في الحسابات :

مثال (1)
ما عدد المكافئات الجرامية لحامض الكبريتيك الذي يحتوي اللتر من محلوله على98 جم منه؟
الحل :

مثال (2) :
ما عيارية حامض الهيدروكلوريك الذي يحتوي اللتر الواحد من محلوله على 37.4 جم من غاز HCI ؟
الحل :

مثال (3) :
ما عيارية محلول حجمه 500مل من NaOH يحتوي على 20 جم من القاعدة ؟
الحل :

مثال (4) :
ما عيارية محلول يحتوي علي عدد 3 من المكافئات الجرامية لمادة ما في اللتر الواحد منه ؟
الحل :

مثال (5) :
ما عدد جرامات نترات الفضة اللازمة لتحضير 50سم 3 من محلولها الذي درجة تركيزه N 0.125 ؟
الحل :

ومن تعريف العيارية نستنتج أن أي حجم من أي محلول يكافئ كيميائياً نفس الحجم من أي محلول يتفاعل معه مادامت قوتا المحلول العياريتان متساويتين . لأن الأوزان المكافئة للمواد متكافئة كيميائياً . فعندما يتعادل مل من محلول ما عباريته مع V2 مل من محلول آخر عياريته N فإن عدد المكافئات الجرامية أو المللجرامية المذابة في كل من الحجمين متساوي وتكون :
N1 V1 = N2 V2
2 - المولارية : ( Molarity ( M
تعرف مولارية المحلول بأنها عدد الأوزان الجزيئية moles الجرامية من المادة المذابة في لتر واحد . ويسمى المحلول بالمولاري Molar solution إذا كان اللتر الواحد منه محتوياً على وزن جزيئي جرامي واحد من المادة

مثال (6) :
ما عدد الجرامات من نترات الفضة اللازمة لتحضير 500 مل من محلولها الذي درجة تركيزه 0.125 M ؟
الحل :

3- التركيز المئوي الوزني :
ويكون على نوعين :
1- عدد جرامات المذاب في 1000 جم من المحلول فإذا قيل بأن تركيز محلول . 10 % فذلك يعني أن المحلول يتكون من 10جم من المذاب لكل 90 جـم مــن المذيب ، أو أن :

4- التركيز المولالي : Molality
ويعرف التركيز المولالي أنه عدد مولات المذاب في 1000 جم من المذيب
مثال (7) :
ما التركيز المولالي لمحلول هيدروكسيد الناتج من إذابة 4 جم منها في 2 لتر من الماء ؟ علماً بأنه كثافة الماء في درجة حرارة  20 م هي 1 جم / سم3
20 م هي 1 جم / سم3
الحل :

5- التركيز بالكسر المولي :
وهو الكسر الذي يمثل نسبة مولات المذاب إلى مولات المحلول كله ( أي المذاب والمذيب ) ولما كانت خواص المحاليل تعتمد هذه النسبة فإن طريقة التعبير بالكسر المولي كثيرة الاستعمال في الكيمياء الفيزيائية . فلو فرضنا بأن W1 يمثل عدد مولات المذاب و W2 يمثل عدد مولات المذيب في محلول معين فإن الكسور المولية للمذاب والمذيب يعبر عنها مما يأتي:
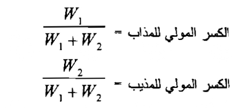
إن مجموع الكسر المولي للمذاب والكسر المولي للذيب يجب أن يساوي واحداً صحيحاً .
6- نسبة الوزن إلى الحجم : W/V
من الممكن التعبير عن التراكيز بنسبة وزن المادة إلي حجم معين من المحلول مثل جم / لتر أو ملجم / لتر . وهناك نسبة أخري يكثر استعمالها وهي نسبة الأجزاء إلي المليون أو البليون منها أي ppm أو ppb .
إن جزءاً بالمليون مساو إلى مليجرام واحد من المذاب في لتر من المحلول أو المذيب المائي وجزء واحد من بليون يساوي ميكروملجرام من المذاب في لتر من المذيب المائي
7- النسبة الوزنية W/W أو النسبة الحجمية /V :
من الممكن التعبير عن تراكيز المحاليل بنسبة أوزان المذاب إلي المذيب أو بالنسبة بين حجميهما إذا كانت المحاليل سائلة . وتؤخذ نسبة الأوزان W/W بالقياس لمـــا تحتويه 100 من المحلول المذيب من وزن بالجرامات لما تحتويها من المادة المذابة . في حين تمثل نسبة الحجوم بعدد الملليمترات من السائل المذاب في 100 مل من المحلول المذيب . ولأن النسبة المئوية . جزء من مئة فإن هذه النسب يعبر عنها بما يأتي :

مثال ( 8 ) :
احسب النسبة الحجمية لمحلول حضر بإضافة 50 مل من الكحول المثيلي إلى 200 مل من الماء . مع الإفتراض بأن هذه الحجوم قابلة لإضافة ؟
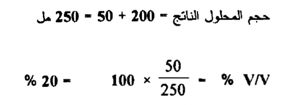
مثال (9) :
احسب النسبة الوزنية لمحلول حضر بإذابة 5جم من نترات الفضة في 100 مل من الماء مفترضاً أن كثافة الماء تساوي 1 جم ؟
الحل :



|
|
|
|
تفوقت في الاختبار على الجميع.. فاكهة "خارقة" في عالم التغذية
|
|
|
|
|
|
|
أمين عام أوبك: النفط الخام والغاز الطبيعي "هبة من الله"
|
|
|
|
|
|
|
بيان مكتب المرجع الديني الأعلى سماحة آية الله العظمى السيد علي الحسيني السيستاني (دام ظله) عقب الهجوم الإرهابي على المسافرين الأبرياء في مدينة پاراچنار، في پاكستان
|
|
|