
Organometallic Coupling Reactions
 المؤلف:
John McMurry
المؤلف:
John McMurry
 المصدر:
Organic Chemistry
المصدر:
Organic Chemistry
 الجزء والصفحة:
9th. p 300
الجزء والصفحة:
9th. p 300
 28-5-2017
28-5-2017
 4622
4622
Organometallic Coupling Reactions
Many other kinds of organometallic compounds can be prepared in a manner similar to that of Grignard reagents. For instance, alkyllithium reagents, RLi, can be prepared by the reaction of an alkyl halide with lithium metal. Alkyllithiums are both nucleophiles and strong bases, and their chemistry is similar in many respects to that of alkylmagnesium halides.

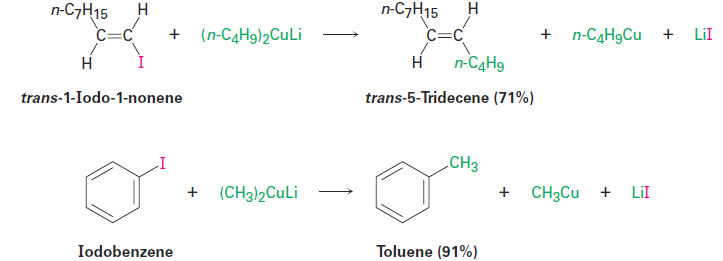
One particularly valuable reaction of alkyllithiums occurs when making lithium diorganocopper compounds, R2CuLi, by reaction with copper(I) iodide in diethyl ether as solvent. Called Gilman reagents (LiR2Cu), lithium diorganocopper compounds are useful because they undergo a coupling reaction with organochlorides, bromides, and iodides (but not fluorides). One of the alkyl groups from the Gilman reagent replaces the halogen of the organohalide, forming a new carbon–carbon bond and yielding a hydrocarbon product. Lithium dimethylcopper, for instance, reacts with 1-iododecane to give undecane in a 90% yield.

This organometallic coupling reaction is useful in organic synthesis because it forms carbon–carbon bonds, thereby allowing the preparation of larger molecules from smaller ones. As the following examples indicate, the coupling reaction can be carried out on aryl and vinylic halides as well as on alkyl halides.
An organocopper coupling reaction is carried out commercially to synthesize muscalure, (9Z)-tricosene, the sex attractant secreted by the common housefly. Minute amounts of muscalure greatly increase the lure of insecticidetreated fly bait and provide an effective and species-specific means of insect control.
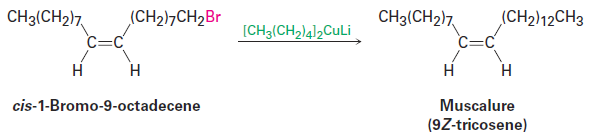
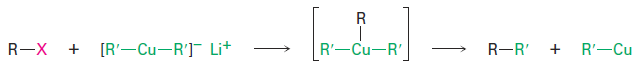
The mechanism of the coupling reaction involves initial formation of a triorganocopper intermediate, followed by coupling and loss of RCu.
In addition to the coupling reaction of diorganocopper reagents with organohalides, related processes also occur with other organometallic reagents, particularly organopalladium compounds. One of the most commonly used procedures is the coupling reaction of an aromatic or vinyl substituted boronic acid [R—B(OH)2] with an aromatic or vinyl substituted organohalide in the presence of a base and a palladium catalyst. This reaction is less general than the diorganocopper reaction because it does not work with alkyl substrates, but it is preferred when possible because it uses only a catalytic amount of metal rather than a full equivalent and because palladium compounds are less toxic than copper compounds. For example:
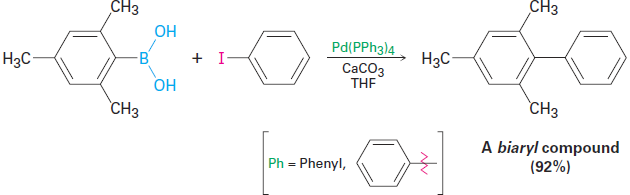
Called the Suzuki–Miyaura reaction, this process is particularly useful for preparing so-called biaryl compounds, which have two conjoined aromatic rings. A large number of commonly used drugs fit this description, so the Suzuki–Miyaura reaction is much-used in the pharmaceutical industry. As an example, valsartan, marketed as Diovan, is a widely prescribed antihypertensive agent whose synthesis begins with a Suzuki–Miyaura coupling of ortho-chlorobenzonitrile with para-methylbenzeneboronic acid.
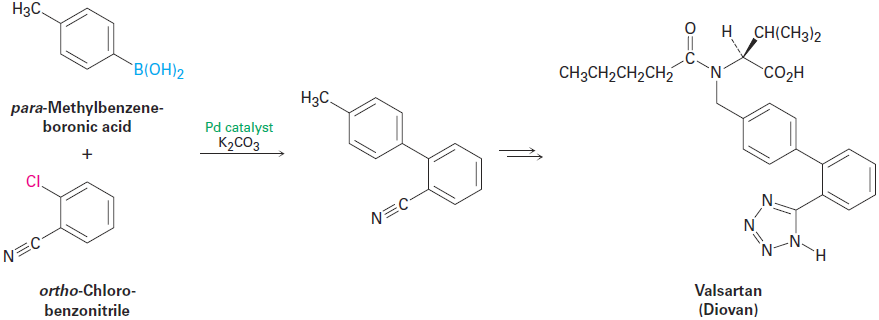
Shown in a simplified form in Figure 1.1, the mechanism of the Suzuki– Miyaura reaction involves initial reaction of the aromatic halide with the palladium catalyst to form an organopalladium intermediate, followed by reaction of that intermediate with the aromatic boronic acid. The resultant diorganopalladium complex then decomposes to the coupled biaryl product plus regenerated catalyst.
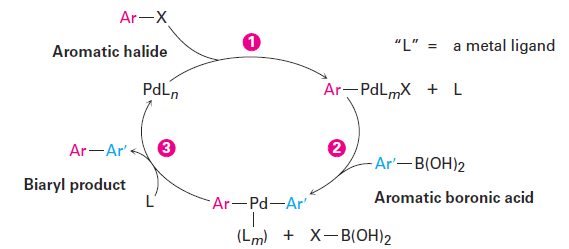
Figure 1.1 Mechanism of the Suzuki–Miyaura coupling reaction of an aromatic boronic acid with an aromatic halide to give a biaryl. The reaction takes place by ( 1 ) reaction of the aromatic halide, ArX, with the catalyst to form an organopalladium intermediate, followed by ( 2 ) reaction with the aromatic boronic acid. ( 3 ) Subsequent decomposition of the diarylpalladium intermediate gives the biaryl product.
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


