

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
المدارات الذرية Atomic orbitals
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 6 6th ed
31-10-2016
12568
المدارات الذرية Atomic orbitals
لا تستطيع المعادلة الموجية أن تعطينا موقع الالكترون بدقة في أي لحظة معينة، كما لا تستطيع أن تحدد السرعة التي يتحرك بها؟ إنها لا تسمح لنا برسم مدار محدد بدقة حول النواة، ولكنها تعطينا احتمال وجود الالكترون في أي مكان محدد.
يدعى المكان من الفراغ الذي يحتمل وجود الالكترون فيه، المدار orbital. وهناك أنواع مختلفة من المدارات؛ مختلفة بمقاساتها وكذلك بأشكالها، وتتوضع حول النواة بطرق محددة. ويتعلق نوع المدار الذي يشغله الكترون بطاقة ذلك الالكترون. إن ما نهتم به هنا هو أشكال هذه المدارات وتوضعاتها بعضها بالنسبة لبعض، لأن هذا الأمر يعين – أو بدقة أبكر يمكن أن نعتقد إنه يعين – ترتيب الذرات في الجزيء فراغياً، وحتى أنه يمكن أن يساعد في تحديد سلوكها الكيميائي. من المناسب أن نصور الالكترون بشكل سحابة. ويمكن التفكير في هذه السحابة على أنها صورة مشوشة لإلكترون يتحرك بسرعة. إن شكل السحابة هو شكل المدار، والسحابة ليست موحدة أو متحانسة فهي كيفية في المواقع التي يكون احتمال وجود الالكترون فيها كبيراً، أي في المواقع التي تكون فيها الشحنة السائبة الوسطية، أو الكثافة الالكترونية، أعظم ما يمكن.
لترى ماهية أشكال بعض المدارات الذرية. يدعى المدار الذري في السوية الطاقية الأخفض؛ المدار 1s. وهو كرة ينطق مركزها على نواة الذرة، كما هو موضح في الشكل 1.1. وليس للمدار حدود محدودة طالما كان هناك احتمال؛ ولو كان ضئيلاً جداً، أن نجد الالكترون منفصلاً عن الذرة – أو حتى أن نجده

الشكل 1.1: المدارات الذرية: المدار s النواة في المركز
عند بعض الذرات الأخرى! مع ذلك فإن هذا الاحتمال يتناقص بسرعة كبيرة بعد مسافة معينة من النواة، وهكذا، فإن توزع الشحنة يمثل جيداً بوساطة السحابة الالكترونية في الشكل (1.1أ). وللتبسيط، يمكن أن نمثل المدار كما في الشكل (1.1ب)، حيث يحدد الخط المستمر المغلق المنطقة التي يقضي فيها الالكترون (لنقل 95%) من وقته.
وفي السوية الطاقية التي تلي ذلك يوجد المدار 2s. وهذا المدار هو أيضاً كرة ينطبق مركزها على النواة الذرية. وهو طبعاً، أكبر من المدار 1s: وتعزى الطاقة الأعلى (الاستقرار الأقل) الى المسافة الوسطية الأكبر بين الالكترون والنواة، وما ينتج عن ذلك من يتناقص في التجاذب الكهرساكن. (فكر بالعمل الواجب بذله – الطاقة التي يجب إعطاؤها للمنظومة – لإزاحة الكترون بعيداً عن النواة ذات الشحنة المعاكسة له).
ويلي ذلك المادر ثلاثة مدارات متساوية الطاقة تدعى المدارات 2p، موضحة في الشكل 2.1. إنه يتألف من انتفاخين تقع بينهما النواة. إن محور كل مدار 2p يتعامد مع محوري المدارين الآخرين، ويفرق بينهما باستخدام الأسماء 2px و 2py و 2pz , حيث تشير x و y و z الى المحاور الموافقة.
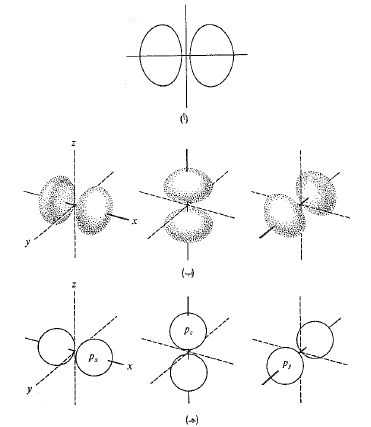
الشكل 2.1: المدارات الذرية: مدارات p، تتعامد المحاور مع بعضها. (أ) مقطع عرضي يبين التفاخي مدار مفرد. (ب) شكل تقريبي على هيئة زوجين من القطوع الناقصة المشوهة. (جـ) تمثيل على هيئة كرتين غير متماستين تماماً.
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















