
الكيمياء المتجانسة واللامتجانسة Homolytic and heterolytic chemistry
 المؤلف:
Robert T. Morrison & Robert. N Boy
المؤلف:
Robert T. Morrison & Robert. N Boy
 المصدر:
الكيمياء العضوية Organic chemistry
المصدر:
الكيمياء العضوية Organic chemistry
 الجزء والصفحة:
p 179 - 6th ed
الجزء والصفحة:
p 179 - 6th ed
 25-12-2016
25-12-2016
 1506
1506
الكيمياء المتجانسة واللامتجانسة Homolytic and heterolytic chemistry
تدين الكيمياء بوجودها الى التحول الكيميائي وهو تحول مادة الى مادة أخرى.
يتحول جزيء قديم الى آخر جديد، أي تنكسر روابط قديمة، وتتشكل روابط جديدة وهي غالباً روابط تشاركية في حالة المركبات العضوية.
يمكن، الآن أن يتحقق كسر رابطة تشاركية بأسلوبين أساسيين مختلفين، تبعاً لما يحدث للألكترونين المشكلين للشفع الرابط، ففي حالة التحلل المتجانس، يذهب كل الكترون الى أحد الشظيتين؛ وفي حالة التحلل اللامتجانس، يذهب الالكترون الى الشظية نفسها. استخدم التعبيران (تحلل متجانس) قد استخدمنا – رغبة في كلمات أفضل – بالمعنى الجدي، لتغطية أسلوب تشكل الرابطة بشكل أفضل، وكذلك لتمييز صنفين عريضين من التفاعلات العضوية.
وهكذا، تكون التفاعلات المتجانسة تلك التفاعلات التي يبتعد فيها الكترونا الشفع الرابط عن بعضهما البعض بشكل منفرد. سواء تكونت الروابط أو كسرت، أو كسرت وتكونت في الوقت نفسه فتأخذ كل من الذرتين المتباعدتين أحد الكتروني الربط، وتقدم كل من الذرتين الراغبتين في الارتباط، أحد الكتروني الربط.
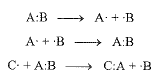
وتكون التفاعلات اللامتجانسة تلك التفاعلات التي يبتعد فيها الكترونا الشفع الرابط على شكل شفع الكتروني. سواء كسرت الروابط أو تكونت، أو كسرت وتكونت في الوقت نفسه، فتأخذ إحدى الذرتين المبتعدتين الالكترونين الرابطين كليهما وتقدم إحدى الذرتين الراغبتين في الاتصال الالكترونين الرابطين كليهما.
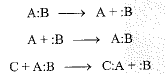
وهكذا، تكون الكيمياء المتجانسة كيمياء الالكترون المفرد؛ وتكون الكيمياء اللامتجانسة، كيمياء الشفع الالكتروني وبينما تعني الكيمياء المتجانسة بالدقائق المعتدلة والمسماة جذوراً حرة، تعني الكيمياء اللامتجانسة بالدقائق الموجبة والسالبة الشحنة، أي بالكاتيونات والأنيونات. تجري التفاعلات المتجانسة نموذجياً، في الطور الغازي، أو في مذيبات لينحصر دورها في تأمين وسط معتدل تستطيع جزيئات المتفاعلات التحرك بحرية فيه.
وتجري التفاعلات اللامتجانسة نموذجياً في محلول تمارس فيه المذيبات كما سنرى، تأثيرات قوية.
تشكل التفاعلات، التي رأيناها سابقاً، المشتملة بشكل رئيسي على التبادل الجذري، الممثل بهلجنة الألكانات – جزءاً من الكيمياء المتجانسة.
لنبدأ، الآن، دراستنا للكيمياء اللامتجانسة. فالقسم الأكبر من الكيمياء العضوية والتفاعل الذي ستبدأ به كما فعلنا في حالة الهلجنة تفاعل استبدال ولكن من نوع آخر مختلف. فهو تفاعل لا متجانس، ومن نوع خاص يسمى (استبدالاً نوكليوفيلياً أليفاتياً nucleophilic aliphatic substitution).
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


