

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
حساب تغير الإنْتروبي في العمليَّات المنعكسة Entropy changes in reversible processes
المؤلف:
د. نضال الرشيدات
المصدر:
دِيناميكا حَراريَّة
الجزء والصفحة:
ج5 ص14-16
17-1-2016
5882
- في العمليَّات الأدياباتيَّة المنعكسة:
يكون السريان الحراري هنا يُساوي صفراً 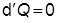 وبالتالي فإنَّه لعمليَّة أدياباتيَّة منعكسة
وبالتالي فإنَّه لعمليَّة أدياباتيَّة منعكسة
|
|
و |
d S = 0 |
تعني هذه العلاقة أنَّ إنْتروبي نظام ما ثابتة في عمليَّة أدياباتيَّة منعكسة والتي يُمكن أنْ نُسمِّيها أيضاً عمليَّةً أيزوإنْتروبيَّة (isentropric process). وهذا هو التفسير للرمز السفلي s الذي استعملناه في الفصليْن السابقيْن عندما كنا نتحدث عن عمليَّات أدياباتيَّة منعكسة.
- في العمليَّات الأيزوحراريَّة المنعكسة:
تكون درجة الحرارة هنا ثابتة وبإمكاننا إخراج T من التكامل في تعريف الإنْتروبي ونجد أنَّ:
|
(1-1) |
|
لإنجاز هذه العمليَّة يُوضع النظام في تماس مع خزَّان درجة حرارته أعلى (أو أقل)بقيمة لامتناهية في الصغر من درجة حرارة النظام. هناك سريان حراري إلى النظام (من النظام) Qr > 0 )Qr < 0) وتكون Sb > Sa )Sb < Sa)، أي أنَّ الإنْتروبي تزداد (تتناقص).
إنَّ أفضل مثال هو عمليَّة تغير طور عند ضغط ثابت وتبقى خلالها درجة الحرارة ثابتة. يكون السريان الحراري، لكُل مول أو لِكُلِّ وحدة كتلة، إلى النظام مساوياً لحرارة التحول l ويكون التغير في الإنْتروبي النوعيَّة هو:
|
(1-2) |
s2 - s1 = l / T |
- في العمليَّات الأيزوحجميَّة والأيزوباريَّة المنعكسة:
يُصاحب السريان الحراري المنعكس من أو إلى النظام تغير في درجة الحرارة ولحساب التغير في الإنْتروبي في مثل هذه العمليَّات يجب حساب التكامل  .
.
في عمليَّة أيزوحجميَّة منعكسة لا يُصاحبها تغير في الطور يكون السريان الحراري مساوياً لـِ cv dT ويُعطى التغير في الإنْتروبي بالعلاقة:
|
(3-1) |
|
وفي عمليَّة أيزوباريَّة منعكسة لا يُصاحبها تغير في الطور يكون السريان الحراري مساوياً لـِ CP dT ويُعطى التغير في الإنْتروبي بالعلاقة:
|
(1-4) |
|
لحساب التكامليْن السابقيْن يجب معرفة السعة الحراريَّة النوعيَّة بتثبيت الحجم و السعة الحراريَّة النوعيَّة بتثبيت الضغط بدلالة درجة الحرارة. لمدىً مُحدَّد من درجات الحرارة حيثُ يُمكن اعتبار cv و cP ثابتتيْن فإنَّ التكامليْن السابقيْن يُصبحان:
|
(1-5) |
|
|
|
عند إخضاع نظام ما إلى عمليَّة فيها سريان حراري قابل للعكس (منعكس) بيْنَ النظام ومحيطه فإنَّ درجة حرارة النظام والمحيط تكونان متساويتيْن، ويكون السريان الحراري إلى المحيط مساوياً في المقدار ومُعاكساً في الإشارة للسريان الحراري إلى النظام، وبالتالي فإنَّ تغير الإنْتروبي الصافي للنظام ومحيطه يُساوي صفراً. كُنَّا قد عرَّفنا الكون بأنَّه مجموع النظام والمحيط ولذا فإنَّنا نستطيع القول أنَّ إنْتروبي الكون لا تتغير أي تبقى ثابتة في كُلِّ تغير لحالة النظام ناتج عن سريان حراري منعكس من النظام أو إليه.
وإذا افترضنا أنَّ حدود النظام الأصلي قد وُسَّعت لتتضمن الخزَّانات الحراريَّة التي تُزوده بالحرارة فإنَّ كُلَّ السريانات الحراريَّة سوف تحدث "داخل" النظام المركب (الجديد). إنَّ هذا يعني عدم وجود سريان حراري عبر الحد الجديد إلى المحيط ويعمل هذا الحدُّ عمل حدٍّ أدياباتي ولذا فإنَّنا نستطيع القول أيضاً أنَّ أيَّة سريانات حراريَّة داخل نظام مركب مُحاط بحدٍّ أدياباتيٍّ لا تُنتج تغيراً صافياً في إنْتروبي النظام المركب.
 الاكثر قراءة في الكيمياء الحرارية
الاكثر قراءة في الكيمياء الحرارية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















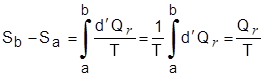
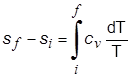
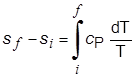
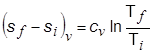


 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















