
التفاعلات مع الحموض والقواعد (Reactions with acids and bases)
 المؤلف:
غاري و. فان لون , ستيفن ج. دفي
المؤلف:
غاري و. فان لون , ستيفن ج. دفي
 المصدر:
كيمياء البيئة نظرة شاملة
المصدر:
كيمياء البيئة نظرة شاملة
 الجزء والصفحة:
ص 732-733
الجزء والصفحة:
ص 732-733
 2024-01-09
2024-01-09
 1228
1228
وفقاً لما أشرنا إليه سابقاً، يُعتبر التركيب المعدني العامل الرئيسي المحدد لعامل الحموضة pH المتأصل في التربة. وعندما تكون كربونات المعادن موجودة، تقع قيمة عامل حموضة التربة عادة في المجال 7.5-8 من ناحية أخرى، تتصف التربة التي تحتوي على كميات كبيرة من أيونات الألمنيوم (III) والحديد (III) القابلة للمبادلة، أو الغنية بالمادة العضوية، بأنها حمضية إلى حد ما عموماً. وتتأثر قيمة عامل حموضة التربة أيضاً بالمواد الحمضية التي ترد إليها من مصادر متنوعة تقترن بتفاعلات تولد الحموض طبيعياً. ويحتوي أحد مصادر الحموض على متعضيات مكروية تطلق في أثناء تنفسها ثاني أكسيد الكربون. لذا فإن تنفس المتعضيات المكروية يُغني جو التربة بثاني أكسيد الكربون الذي يؤدي إلى تخفيض قيمة pH في محلولها. وينجم انخفاض آخر في قيمة عامل حموضة التربة عن تكوين حموض عضوية بواسطة المتعضيات الحيوية التي تفكك كتلة التربة الحيوية. لكن هذه العوامل تتأثر بالمناخ والظروف، والنتيجة النهائية هي وجود مجال لقيم pH الطبيعية الممكنة في أنواع التربة المختلفة.
وثمة أيضاً مصادر متنوعة للحموضة تنجم عن الأنشطة البشرية، إلا أن اثنين منها يبرزان بصفتهما ذوي أهمية خاصة من الناحية الكمية. توفّر المتساقطات الجوية الحمضية في أماكن مختلفة من العالم كميات كبيرة من أيونات الهدرونيوم للتربة. وقيمة pH الوسطية للمتساقطات السنوية المساوية لـ 4.2 ليست استثنائية في بعض أجزاء أوروبا الشمالية وشرق أمريكا الشمالية الشكل (2.5) خُذ منطقة مساحتها 1 هكتار، وكمية الأمطار التي تهطل فيها سنوياً تساوي mm 1000 ( أي 1 متر)، والقيمة الوسطى لـ pH الأمطار تساوي 4.2 حينئذ يُعطى عدد مولات الحمض الكلي المتساقطة على 1 هكتار من التربة بـ:
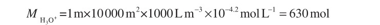
أما المصدر الثاني الشائع جداً لزيادة حموضة التربة فهو السماد الذي يحتوي على النتروجين بصيغة مُرجَعة تخضع للنترتة. على سبيل المثال، خُذ حالة يُضاف فيها 200 كيلو غرام من النتروجين إلى الهكتار بصيغة كبريتات أمونيوم صلبة. وهذا يكافئ إضافة 200000g/14gmol، أي 14000mol من النتروجين بصيغة أيونات أمونيوم.
تفاعل النترتة الأولي هو :
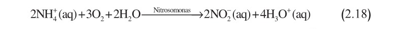
ونظراً إلى كون أمثال التفاعل صحيحة في هذه المعادلة، وبعد اكتمال التفاعل، يكون قد تولد 28000 مول من أيونات الهدرونيوم محلياً في التربة فوق المساحة 1 هكتار. ولا تؤدي أكسدة النتريت اللاحقة، التي تعطي نترات، إلى تكوين أي حمض أو أساس آخر. والنتيجة الواضحة التي غالباً ما تُغفَل هي أن استعمال أسمدة النتروجين يمكن أن تُسهم على نحو أكبر في حموضة التربة مما تفعله الأمطار الحامضية.
ثمة كثير من التفاعلات الممكنة لتعديل الحموضة التي تُضاف إلى التربة أو تتكون فيها. والعوامل التي تحدّد التفاعل الذي يجب اختياره تتضمن طبيعة التربة موضوع الاهتمام، ووجود المزروعات والأيونات السالبة المقترنة بالحموضة المضافة. ويمكن تقسيم أنواع التفاعلات التي تعدل الحموضة إلى فئتين، هما الفئة الكيميائية الأرضية (geochemical) والفئة الحيوية.
 الاكثر قراءة في كيمياء البيئة
الاكثر قراءة في كيمياء البيئة
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


