

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
تفاعلات الألدهيدات والكيتونات
المؤلف:
أ. د محمد مجدي واصل
المصدر:
اساسيات الكيمياء العضوية
الجزء والصفحة:
ص 354 -355-356 -357 -358-359 -360 -361-362 -363-364-365-366
2023-08-24
18335
تعتبر مجموعة الكربونيل من المجوعات الوظيفية النشطة كيميائياً حيث أن لها تفاعلات كيميائية كثيرة ذات أهمية كبيرة في اصطناع الكثير من المركبات العضوية . ومن هذه التفاعلات :
1- التأكسد 2- الاختزال 3- الإضافة النيوكليوفيلية
4- التفاعل مع مشتقات الأمونيا 5- البلمرة
6- تكاثف الدول وتفاعل كانيزارو 7- تفاعلات الإبدال
التأكسد :
بالرغم من أن الألدهيدات والكيتونات لا تختلف كثيراً في فعاليتها الكيميائية بشكل عام فإن كل منها تختلف عن الأخرى في تفاعلات الأكسدة . فالألدهيدات سهلة التأكسد بينما الكيتونات يصعب أكسدتها مما يتطلب ذلك من كسر رابطة كربون - كربون .
أكسدة الألدهيدات :
تتحول الألدهيدات عند أكسدتها بثنائي كربونات الصوديوم الحمضية إلى الأحماض الكربوكسيلية دون تغيير في الهيكل الكربوني :

كما يمكن للألدهيدات أن تتأكسد حتى بواسطة كواشف مؤكسدة خفيفة مثل كاشف تولينز ومحلول فهلنج وكذلك محلول بندكت . وتعتبر هذه من الاختبارات التي تميز الألدهيدات عن الكيتونات ويكون العنصر المؤكسد في كاشف تولينز هو أيون الفضة ( Ag+ ) وأيون النحاس ( Cu+) في كاشف فهلنج وتتم الاختبارات الثلاثة في محاليل قاعدية .
كاشف تولينز :
تضاف كمية وافرة من محلول الأمونيا إلى محلول قاعدي لنيترات الفضة ليتكون محلول يحتوي على أيون Ag(NH3)2+ ع الذي يعتبر كاشف lمؤكسد خفيف . وعند تسخين الدهيد في كاشف تولينز يختزل أيون الفضة إلى فلز الفضة الذي يظهر على هيئة مرآة على الجدار الداخلي لأنبوبة الاختيار ( النظيفة ) .
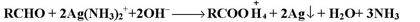
وتستخدم هذه الطريقة تجارياً لصناعة المرايا حيث ترسب الفضة على سطح الزجاج عند استخدام الفورما لدهيد -
اختبار فهلنج :
محلول فهلنج عبارة عن محلول قلوي لمعقد كبريتات النحاس مع أيونات النترات والعامل المؤكسد هو أيون النحاس ( Cu++ ) وعند استخدام محلول فهلنج لأكسدة ألدهيد معين فإن أيون معقد النحاسيك يختزل إلى أكسيد النحاسوز وظهور هذا الراسب الأحمر البرتقالي إشارة إلى وجود مجموعة الألدهيد في الجزئ :
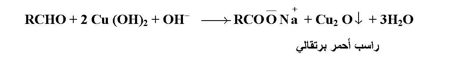
ويستخدم مثل هذا الاختيار إكلينيكياً للكشف عن الجلوكوز في دم الإنسان .
أكسدة الكيتونات :
لا تتأكسد الكيتونات عند الظروف العادية . أما عند تسخينها مع كواشف مؤكسدة قوية مثل حمض النتريك المركز فإنها تعطي أحماض كربوكسيلية بذرات كربون أقل من ذرات كربون الكيتون ذاته كما يلي :
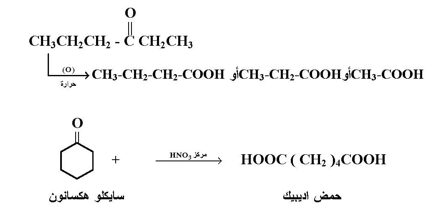
تفاعل هالوفورم :
يتأكسد الأ سيتالدهيد والكيتوؤنات التي تحتوي على مجموعة ( RCOCH3 ) ( أي ميثيل كيتونات ) وكذلك الكحولات ذات الصيغة (RCH-CH3) بواسطة الهالوجينات ( الكلور أو البروم أو اليود ) في محلول OH قاعدي لتعطي ناتج هالوفورم ( CHX3 ) وإذا استخدم اليود يظهر اليودوفورم كراسب أصفر :
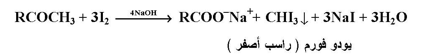
الاختزال :
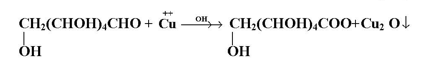
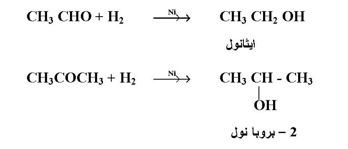
تختزل الألدهيدات أو الكيتونات بالهدرجة المحفزة أي نيكل في وجود الهيدروجين، لتعطي كحولات أولية وثنائية على التوالي :
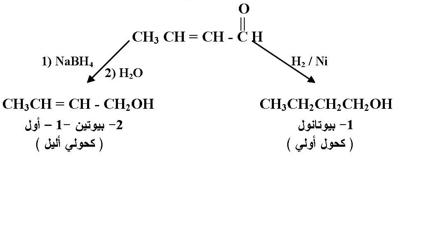
وعند وجود رابطة كربون - كربون المزدوجة في الألدهيدات والكيتونات فيمكن اختبار الظروف المناسبة لاختزال مجموعة الكربونيل دون المساس برابطة كربون - كربون المزدوجة وذلك باستخدام الهيدريدات الفلزية مثل : LiAIHS4 او NaBH4 يتبع ذلك تحلل مائي .
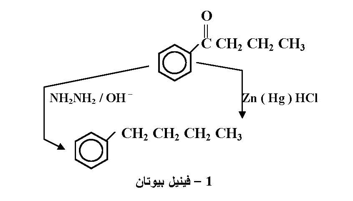
كما يمكن اختزال مجموعة الكربونيل ( C=O ) إلى مجموعة ميثلين ( CH2 ) بطريقتين :
أ - اختزال كليمنسن ، وفيه يستخدم ملغم الخارصين وحمض HCl .
ب- اختزال وولف - كيشنز الذي يستخدم هيدرازين هيدريت في محلول القاعدي .
الإضافة النبوكليوفيلية :
بالإضافة إلى القطبية العالية لمجموعة الكربونيل وكذلك سهولة إزاحة الكترونات «الخاصة بها فإن مجموعة الكربونيل تهيئ مركزاً البكتروفيلياً ( ذرة كربون تحمل شحنة جزيئية موجبة ) للتفاعل مع كواف نيوكليوفيلية لتعطي نواتج إضافة :
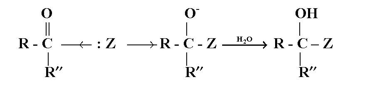
وفي حالة استخدام كواشف نيوكليوفيلية ضعيفة مثل الماء والكحولات فعادة ما اتحفز مثل هذه التفاعلات يحمض :

وتعتبر تفاعلات الإضافة النيوكليوفيلية من أهم التفاعلات الخامسة بالألدهيدات والكيتونات . ونلاحظ أن تهجين ذرة كربون مجموعة الكربونيل في الألدهيدات أو الكيتون يتحول من SP2 إلى SP3 في الناتج ويكون معدل تفاعلات الألدهيدات أسرع من تفاعلات الكيتونات نظراً إلى الإعاقة الفراغية في الكيتونات .
1- إضافة الماء :
عند إضافة عناصر الماء إلى رابطة كربونيل في الألدهيدات أو الكيتونات يحصل على مركبات غير ثابتة :
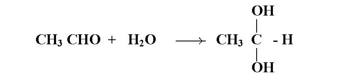
ويستثنى من ذلك كلورال أو ثلاثي كلوراسيتالدهيد ليعطي ناتج ثابت يطلق عليه هيدرات كلورال :
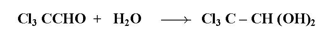

2- إضافة كبريتيت الصوديوم الهيدروجينية :
تتفاعل الألدهيدات وميثيل كيتونات مع محلول مائي مشبع من (NaHSO3)لتعطي أملاح كنواتج إضافة تتفصل من المحاليل :

ويمكن لهذه الأملاح أن تتمياً في وسيط حمضي أو قاعدي لتعطي ثانية مركبات الكربونيل . لذا فإن تكوين مثل هذه الأملاح ثم تميؤها تعتبر طريقة جيدة لتنقية مركبات الكربونيل وفصلها عن مركبات أخرى .
3- إضافة سيانيد الهيدروجين :
يضاف سيانيد الهيدروجين ( أو سيائيد الصوديوم في وجود حمض الكبريتيك ) إلى الألدهيدات والكيتونات لتعطي مركبات إضافة يطلق عليها سيانو هيدرينات :
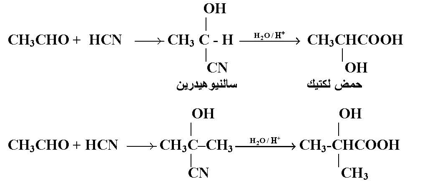
ويمكن تحويل مجموعة سيان ( أو سيانيوهيدرينات ) بالتميؤ الحمضي أو القاعدي إلى مجموعة كربوكسيل أي تحويل سيانوهيدرينات إلى أحماض الفاهيدروكسي كربوكسيلية الهامة في كثير من الصناعات الكيميائية .
4- إضافة الإستيليدات :
تضاف الإستيليدات الفلزية إلى مركبات الكربونيل ( طريقة مشابهة لإضافة كواشف جرينيارد ) لتعطي الكوكسيدات وسيطة التي تتمياً بدورها لتعطي كحولات إستيلينية :
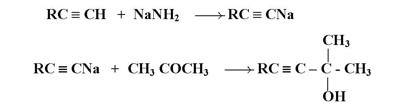
5- إضافة الكحولات :
تضاف الكحولات إلى الألدهيدات والكيتونات في وجود غاز HCl حيث يتكون نصف اسيتال في المرحلة الأولى ثم اسيتال بالنسبة للألدهيدات ونصف كيتال ثم كيتال بالنسبة للكيتونات :
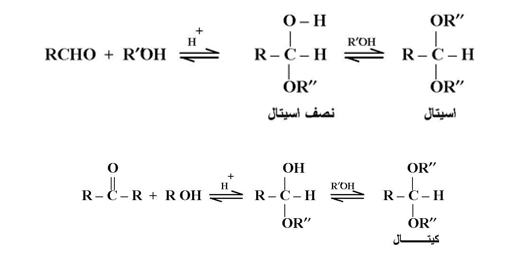
ويلاحظ أن التفاعلات تكون في حالة إتزان في جميع المراحل ؛ ولذا فإنه يمكن إستعادة الألدهيدات أو الكيتونات عند المعالجة بحمض مخفف . ويمكن إستخدام كحول ثنائي الهيدروكسيل مثل جليكول إيثلين لحماية مجموعة الكربونيل في الدهيد أوكيتون عند إجراء تفاعل معين على جزء آخر من الجزئي ؛ ثم تستعاد مجموعة الكربونيل بالتميؤ
6- إضافة كواشف جرينيارد :
تضاف كواشف جرينيارد الألكيلية والأريلية إلى الألدهيدات والكيتونات في ظروف جافة لتعطي كحولات بأنواعها الأولية والثنائية والثلثية :

التفاعل مع مشتقات الأمونيا :
عند تفاعل الألدهيدات والكيتونات مع الأمونيا فأنها تعطي مركبات يطلق عليها " أيمينات " تكون غير ثابتة (باستثناء عند استخدام الفورمالدهيد) وسرعان ما تتأثر بالماء لتعطي ثانيه الألدهيدات والكيتونات :

لكن عند استخدام بعض مشتقات الأمونيا للتفاعل مع الألدهيدات وكيتونات فإنها تتكون نواتج بلورية ثابتة ذات درجات إنصهار مرتفعة .
تكائف الدول :
تتكاثف الألدهيدات والكيتونات التي لها ذرات هيدروجين من نوع ألفا في وجود قاعدة قوية لتعطي نواتج تعرف بنواتج الدول ( الدهيد أو كيتون كحولي ) :

ومثل هذه النواتج تفقد بسهولة جزئ ماء لتعطي مركبات غير مشبعة ألفا - بيتا تكون أكثر ثباتاً وأستقراراً :

تكاثف الدول المزدوج :
عند تكاثف جزيئي الدهيد ( أو كيتون ) أحدهما لدية ذرات هيدروجين من نوع ألفا والجزئ الآخر ليس لديه من نوع ذرات هيدروجين ألفا ( مثل البنزالدهيد ) في وجود وسيط قاعدي فأنه يتم التفاعل ليعطي مركب غير مشبع ألفا - بيتا فمثلاً عند تكاثف الأسيتالدهيد والبنزالدهيد نحصل على سينامالدهيد ( وهو زيت القرفة ) :

تفاعل كانيزارو :
تتفاعل الألدهيدات التي ليس لها ذرات هيدروجين في محلول قاعدي مركز لتنتج مخلوطاً متساو ومن كحول وملح حمض كربوكسيلي المقابل للألدهيد المستخدم ويعرف هذا بتفاعل كانيزارو مثال :

تفاعل كانيزارو المختلط أو المزدوج :
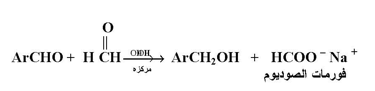
عند تفاعل نوعين من الألدهيدات التي ليس لها ذرات هيدروجين عند ظروف تفاعل كانيزارو ( قاعدة مركزة ) فإنها تتكون كل النواتج الممكنة وإذا كان الفورمالدهيد هو أحد الألدهيدات المستخدمة فإن الناتج عادة ما يكون عبارة عن مخلوط من فورمات الصوديوم والكحول المقابل للألدهيد الأخر المستخدم وهذا ما نطلق عليه بتفاعل كانيزارو المختلط أو المزدوج أو المتصالب .
وحيث أن الفورمالاهيد يكون قابلاً للأكسدة فإن تفاعل كانيزارو المختلط يصبح طريقة مهمة لتحضير مختلف أنواع الكحولات الأروماتية مثال :
الفورمالدهيد :
يتحول غاز الفورمالدهيد إلى محول مائي بتركيز %37 يسمي فورمالين ويكون على هيئة هيدرات (OH – CH2 – (HO وإذا ترك لفترة زمنية فيمكن له أن يتبلمر فيعطي ثلاثي اكسي ميثلين أو تربوكسان

وعند تبخير الفورمالين على حمام مائي ؛ يتكون مبلمر خطي يعرف باسم بارا فور مالدهيد : أو بارا فورم يكون ثابتاً عند الظروف العادية :
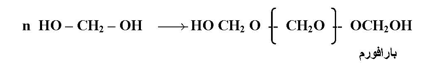
حيث تكون n= من 10 الى 100 ؛ ويستخدم فورمالدهيد أو تربوكسان كمصدر للفورمالدهيد حيث يتم الحصول عليه وقت الحاجة بالتسخين .
ويتبلمر أسيتالدهيد بوجود كمية حفزية من حامض الكبريتيك المركز ليعطي بارالدهيد كما يلي :

تفاعلات الإبدال على ذرات هبدروجين ألفا :
يمكن هلجنة ( الكلور أو البروم ) الألدهيدات أو الكيتونات التي لها ذرات هيدروجين ألفا ( مثل الأسيتون ) في وجود حمض أو قاعدة :

تفاعلات الإبدال على مجموعة الكربونيل :
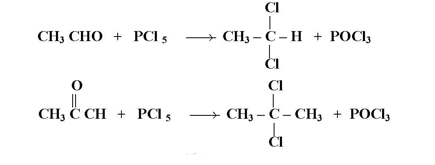
تتفاعل الألدهيدات أو الكيتونات مع خامس كلوريد الفوسفور حيث تستبدل ذرة الأكسجين بذرتي هالوجين لتتكون هاليدات ثنائية توأمية :
 الاكثر قراءة في الهايدروكاربونات
الاكثر قراءة في الهايدروكاربونات
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















