
What is Regiochemistry and How Does It Apply?
 المؤلف:
LibreTexts Project
المؤلف:
LibreTexts Project
 المصدر:
................
المصدر:
................
 الجزء والصفحة:
.................
الجزء والصفحة:
.................
 15-1-2020
15-1-2020
 2023
2023
What is Regiochemistry and How Does It Apply?
Regiochemistry deals with where the substituent bonds on the product. Zaitsev's and Markovnikov's rules address regiochemistry, but Zaitsev's rule applies when synthesizing an alkene while Markovnikov's rule describes where the substituent bonds onto the product. In the case of electrophilic hydration, Markovnikov's rule is the only rule that directly applies. See the following for an in-depth explanation of regiochemistry Markovnikov explanation: Radical Additions--Anti-Markovnikov Product Formation
In the mechanism for a 3º alcohol shown above, the red H is added to the least-substituted carbon connected to the nucleophilic double bonds (it has less carbons attached to it). This means that the carbocation forms on the 3º carbon, causing it to be highly stabilized by hyperconjugation—electrons in nearby sigma (single) bonds help fill the empty p-orbital of the carbocation, which lessens the positive charge. More substitution on a carbon means more sigma bonds are available to "help out" (by using overlap) with the positive charge, which creates greater carbocation stability. In other words, carbocations form on the most substituted carbon connected to the double bond. Carbocations are also stabilized by resonance, but resonance is not a large factor in this case because any carbon-carbon double bonds are used to initiate the reaction, and other double bonded molecules can cause a completely different reaction.
If the carbocation does originally form on the less substituted part of the alkene, carbocation rearrangements occur to form more substituted products:
- Hydride shifts: a hydrogen atom bonded to a carbon atom next to the carbocation leaves that carbon to bond with the carbocation (after the hydrogen has taken both electrons from the single bond, it is known as a hydride). This changes the once neighboring carbon to a carbocation, and the former carbocation becomes a neighboring carbon atom.
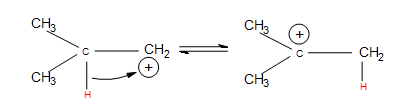
- Alkyl shifts: if no hydrogen atoms are available for a hydride shift, an entire methyl group performs the same shift.
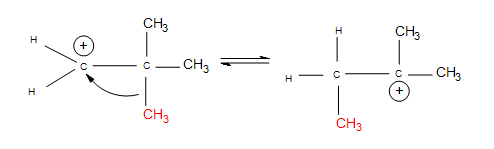
The nucleophile attacks the positive charge formed on the most substituted carbon connected to the double bond, because the nucleophile is seeking that positive charge. In the mechanism for a 3º alcohol shown above, water is the nucleophile. When the green H is removed from the water molecule, the alcohol attached to the most substituted carbon. Hence, electrophilic hydration follows Markovnikov's rule.
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


