
Directed Aldol Reactions
 المؤلف:
William Reusch
المؤلف:
William Reusch
 المصدر:
Virtual Textbook of Organic Chemistry
المصدر:
Virtual Textbook of Organic Chemistry
 الجزء والصفحة:
............
الجزء والصفحة:
............
 5-8-2018
5-8-2018
 1810
1810
Directed Aldol Reactions
The aldol reaction is potentially a powerful synthetic tool. As demonstrated by the following equation, a directed aldol reaction between different aldehydes would produce a single crossed aldol product (the new bond is colored maroon) and create two new stereogenic centers (colored blue). However, conducting this reaction with aqueous NaOH usually generates a mixture of four different adducts, and frequently β-elimination of water when possible.
R1CH2CHO |
+ |
R2CH2CHO |
base
 |
R1CH2CH(OH)—CH(R2)CHO |
| Carbonyl Acceptor |
|
Enolate Donor |
|
One Crossed Aldol Product |
In this section methods of controlling the enolate donor and carbonyl acceptor reactants to produce a single aldol product will be described and discussed. Several important principles must be taken into consideration for this purpose.
• The conventional aldol reaction is reversible. (aqueous base at room temperature)
• The initial aldol product may undergo beta-elimination of water, depending on reaction conditions.
• Regioselective enolate anion formation may be achieved by using differences in kinetic vs. equilibrium acidities of α-hydrogens.
• Enolate anions may be trapped as silyl ethers and used subsequently for controlled aldol reactions.
• Enolate-like species may be used for aldol-like reactions with carbonyl compounds, and hydrolyzed later to aldol products.
• Metal cations or other electrophilic moieties may act to orient the reactants in specific ways.
The reversibility of conventional aldol reactions is illustrated by the crossed aldol condensation of 2-butanone with benzaldehyde, illustrated below. The methyl hydrogens are kinetically more acidic than the methylene hydrogens, so the α'-enolate is generated more rapidly than the more substituted α-enolate. As a rule, ketone enolate bases react more rapidly with aldehydes than with ketones, so self condensation of the ketone is minimal. Both enolate anions add reversibly to benzaldehyde to form β-hydroxy ketones; however, the α-enolate product (on the left) reverts to reactants faster than it eliminates water. In contrast, the isomeric α'-enolate product (on the right) undergoes rapid β-elimination to the observed 5-phenyl-4-penten-3-one final product.
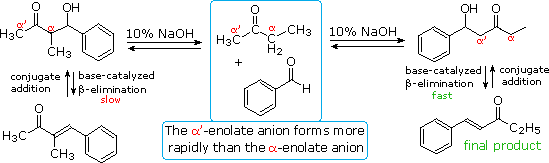
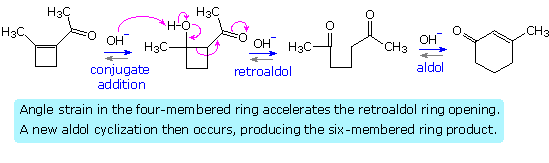
Acid catalysis of the 2-butanone-benzaldehyde reaction gives the isomer, 3-methyl-4-phenyl-3-buten-2-one, as the chief product, thanks to the predominance of the more substituted α-enol as an intermediate. In this case both β-hydroxy ketone intermediates undergo reversible dehydration.
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


