

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
Reduction by Complex Metal Hydrides
المؤلف:
William Reusch
المصدر:
Virtual Textbook of Organic Chemistry
الجزء والصفحة:
............
5-8-2018
2927
Reduction by Complex Metal Hydrides
Addition of a hydride anion to an aldehyde or ketone would produce an alkoxide anion, which on protonation should yield the corresponding alcohol. Aldehydes would give 1º-alcohols (as shown) and ketones would give 2º-alcohols.
RCH=O + H:(–)  RCH2O(–) + H3O(+)
RCH2O(–) + H3O(+)  RCH2OH
RCH2OH
Two practical sources of hydride-like reactivity are the complex metal hydrides lithium aluminum hydride (LiAlH4) and sodium borohydride (NaBH4). These are both white (or near white) solids, which are prepared from lithium or sodium hydrides by reaction with aluminum or boron halides and esters. Lithium aluminum hydride is by far the most reactive of the two compounds, reacting violently with water, alcohols and other acidic groups with the evolution of hydrogen gas. The following table summarizes some important characteristics of these useful reagents.
|
Reagent |
Preferred Solvents |
Functions Reduced |
Reaction Work-up |
|---|---|---|---|
| Sodium Borohydride NaBH4 |
ethanol; aqueous ethanol 15% NaOH; diglyme avoid strong acids |
aldehydes to 1º-alcohols ketones to 2º-alcohols inert to most other functions |
1) simple neutralization 2) extraction of product |
| Lithium Aluminum Hydride LiAlH4 |
ether; THF avoid alcohols and amines avoid halogenated compounds avoid strong acids |
aldehydes to 1º-alcohols ketones to 2º-alcohols carboxylic acids to 1º-alcohols esters to alcohols epoxides to alcohols nitriles & amides to amines halides & tosylates to alkanes most functions react |
1) careful addition of water 2) remove aluminum salts 3) extraction of product |
Some examples of aldehyde and ketone reductions, using the reagents described above, are presented in the following diagram. The first three reactions illustrate that all four hydrogens of the complex metal hydrides may function as hydride anion equivalents which bond to the carbonyl carbon atom. In the LiAlH4 reduction, the resulting alkoxide salts are insoluble and need to be hydrolyzed (with care) before the alcohol product can be isolated. In the borohydride reduction the hydroxylic solvent system achieves this hydrolysis automatically. The lithium, sodium, boron and aluminum end up as soluble inorganic salts. The last reaction shows how an acetal derivative may be used to prevent reduction of a carbonyl function (in this case a ketone). Remember, with the exception of epoxides, ethers are generally unreactive with strong bases or nucleophiles. The acid catalyzed hydrolysis of the aluminum salts also effects the removal of the acetal. This equation is typical in not being balanced (i.e. it does not specify the stoichiometry of the reagent).
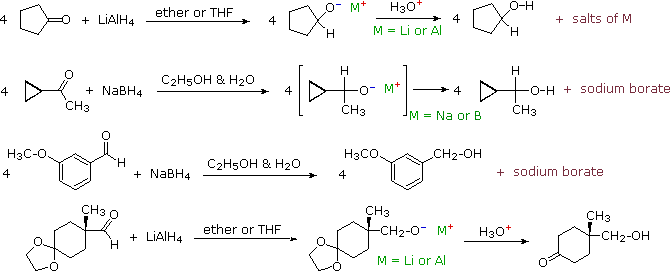
Reduction of α,β-unsaturated ketones by metal hydride reagents sometimes leads to a saturated alcohol, especially with sodium borohydride. This product is formed by an initial conjugate addition of hydride to the β-carbon atom, followed by ketonization of the enol product and reduction of the resulting saturated ketone (equation 1 below). If the saturated alcohol is the desired product, catalytic hydrogenation prior to (or following) the hydride reduction may be necessary. To avoid reduction of the double bond, cerium(III) chloride is added to the reaction and it is normally carried out below 0 ºC, as shown in equation 2.
| 1) RCH=CHCOR' | + | NaBH4 (aq. alcohol) | ——> | RCH=CHCH(OH)R' | + | RCH2-CH2CH(OH)R' |
| 1,2-addition product | 1,4-addition product | |||||
| 2) RCH=CHCOR' | + | NaBH4 & CeCl3 -15º | ——> | RCH=CHCH(OH)R' | ||
| 1,2-addition product | ||||||
Before leaving this topic it should be noted that diborane, B2H6, a gas that was used in ether solution to prepare alkyl boranes from alkenes, also reduces many carbonyl groups. Consequently, selective reactions with substrates having both functional groups may not be possible. In contrast to the metal hydride reagents, diborane is a relatively electrophilic reagent, as witnessed by its ability to reduce alkenes. This difference also influences the rate of reduction observed for the two aldehydes shown below. The first, 2,2-dimethylpropanal, is less electrophilic than the second, which is activated by the electron withdrawing chlorine substituents.
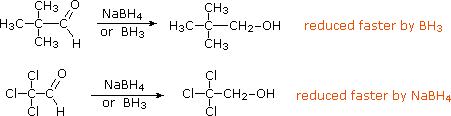
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















