


 الفاكهة والاشجار المثمرة
الفاكهة والاشجار المثمرة
 نخيل التمر
نخيل التمر
 الحمضيات
الحمضيات 
 الاشجار ذات النواة الحجرية
الاشجار ذات النواة الحجرية
 المحاصيل
المحاصيل
 المحاصيل البقولية
المحاصيل البقولية
 محاصيل الالياف
محاصيل الالياف
 محاصيل زيتية
محاصيل زيتية
 محاصيل الحبوب
محاصيل الحبوب 
 محاصيل الخضر
محاصيل الخضر
 القرعيات
القرعيات 
 المحاصيل المنبهة و المحاصيل المخدرة
المحاصيل المنبهة و المحاصيل المخدرة
 المحاصيل السكرية
المحاصيل السكرية 
 نباتات الزينة والنباتات الطبية والعطرية
نباتات الزينة والنباتات الطبية والعطرية
 الحشرات النافعة
الحشرات النافعة
 النحل
النحل 
 دودة القز(الحرير)
دودة القز(الحرير)
 تقنيات زراعية
تقنيات زراعية
 التصنيع الزراعي
التصنيع الزراعي 
 الانتاج الحيواني
الانتاج الحيواني 
 الطيور الداجنة
الطيور الداجنة
 الاسماك
الاسماك
 الابقار والجاموس
الابقار والجاموس
 الاغنام
الاغنام 
 آفات وامراض النبات وطرق مكافحتها
آفات وامراض النبات وطرق مكافحتها 
 الحشرات
الحشرات 
 امراض النبات ومسبباتها
امراض النبات ومسبباتها 
 الحشائش والنباتات الضارة
الحشائش والنباتات الضارة |
أقرأ أيضاً
التاريخ: 20-11-2017
التاريخ: 20-11-2017
التاريخ: 2024-11-13
التاريخ: 8-7-2019
|
الاسمدة الفوسفاتية Phosphate Fertilizers
في البداية لابد من التطرق الى بعض المفاهيم ذات العلاقة بالفسفور في التربة والجاهزية.
اقسام فسفور التربة من حيث الجاهزية للنباتات هي:
* الفسفور الذائب Soluble Phosphorus:
وهو جاهز بشكل مباشر الا ان تركيزه قليل جداَ (3.0-0.3 جزء بالمليون او 0.3 - 3.0 ملغم. لتر- 1). والفسفور في هذا الجز يكون على هيئة الاورثوفوسفات الاحادية والثنائية (H2PO4-1 , HPO4-2). النبات يمتص H2PO4-1 بسرعة تقدر بعشرة اضعاف امتصاص HPO4-2. النسبة بين H2PO4-1 و HPO4-2 تعتمد على pH الوسط وتساوي واحد عند 7.22 والصورة H2PO4-1 تزداد في الوسط الحامضي.
* الفسفور القابل للتجهيز (الفسفور القابل للتغير) Lablie Phosphorus:
وهو الفسفور الممتز على الاسطح المختلفة للتربة ويمكن ان يتحرر الى المحلول ويمثل الفسفور الجاهز للامتصاص بوساطة جذور النباتات (علي واحمد 2000).
* الفسفور بطئ الجاهزية (الفسفور غير القابل للتغير) Slowly Available Phosphorus:
ويكون قليل الذوبانية الى قليل جداَ لاسيما عند تحوله الى صخر الابتايت.
وبشكل عام الفسفور الجاهز للامتصاص من قبل النبات عبارة عن الفسفور الذائب بالماء (فسفور محلول التربة) والفسفور القابل للتجهيز, والذي يمثل الفسفور الممتز على الاسطح المختلفة في التربة (اسطح معادن الطين والكاربونات والمادة العضوية) او الفسفور المترسب الا انه لا يزال في مراحل وسطية ولم يصل الى المستوى المتقدم من الترسيب.
الفسفور المضاف الذي لا يمتصه النبات او الفائض عن الامتصاص سيتعرض الى عمليات الامتزاز والترسيب او الاحتفاظ للتربة بالفسفوراو الحجز. وعملية الترسيب هذه تعتمد بشكل رئيس على درجة تفاعل التربة (Soil pH)، اذ ان الترسيب في الترب الحامضية يكون على هيئة فوسفات الحديد والالمنيوم (Al,Fe-P)، اما في الترب القاعدية فيكون على شكل فوسفات الكالسيوم Ca- P) ).
السماد الفوسفاتي الذي صيغته Ca(H2PO4)2 (فوسفات الكالسيوم الاحادية MCP) سيتحول الى معادن الفسفور وسلسلة الترسيب في الترب الكلسية والقاعدية تكون كما موضح في المخطط الآتي: -
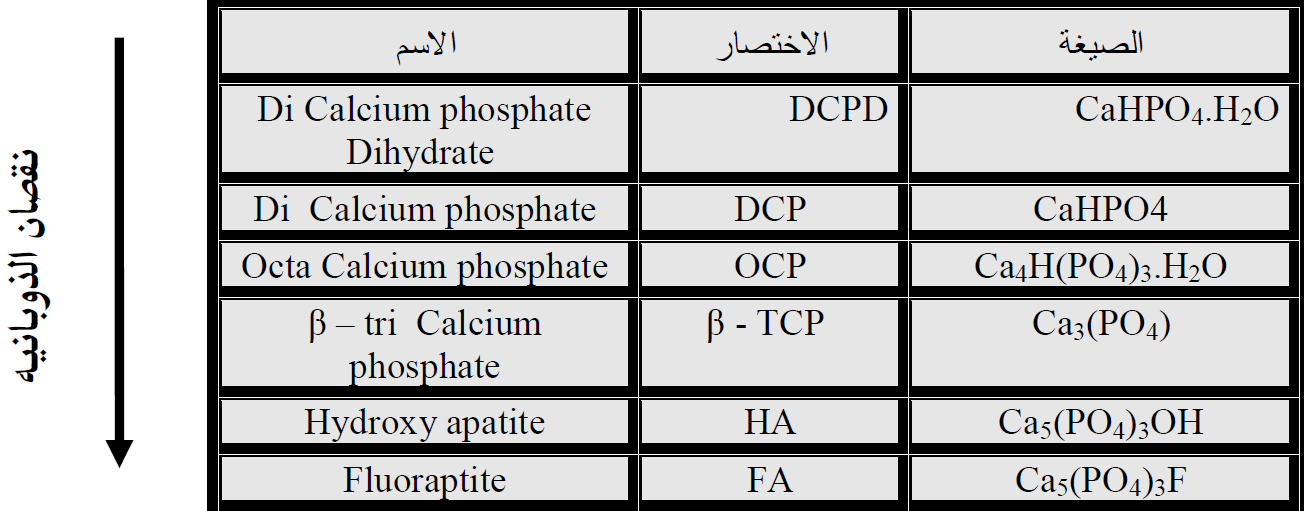
بتعبير اخر خلال اسابيع يتحول من فوسفات الكالسيوم الاحادية MCP الحاوي على الفسفور بصورة H2PO4 (الاحادي) الى فوسفات الكالسيوم الثنائية المائية DCPD و فوسفات الكالسيوم الثنائية DCP الحاوي على الفسفور بصورة (HPO4) وبعد حوالي 5-3 شهور يتحول الى فوسفات الكالسيوم الثمانية OCP الحاوي على الفسفور بصورة PO4 وبعد عشرة شهور الى BTCP ويأخذ فترة اطول او مدة اطول من الزمن ليصل الى الصخر الفوسفاتي HA او الصخر الفوسفاتي FA. ان هذه التفاعلات يصعب السيطرة عليها، ولذا فان كمية الفسفور المسترد او المستعمل من قبل النبات من السماد المضاف تكون واطئة باستمرار مقارنة بالأسمدة النتروجينية.
عملية الامتزاز عبارة عن الامتزاز السطحي Adsorption او الامتزاز بشكل عام Sorption (والذي يشمل الامتزاز السطحي والامتصاص الى داخل الوحدات البنائية)، وتحدث على الاسطح الحاوية على الايونات الموجبة ولاسيما الكالسيوم والمغنيسيوم واسطح كاربونات الكالسيوم ) معادن الكاربونات بشكل عام) وحتى الكميات القليلة من الحديد الموجودة في الترب الكلسية، تساهم في عملية الامتزاز. كذلك اسطح معادن الطين مهمة جداً، وهنا نوع المعدن الطيني والمساحة السطحية للمعدن كلها تؤثر في هذه العملية.
وبشكل عام قوة الربط مع اكاسيد الحديد والالمنيوم تكون عالية، اما مع معادن الكاربونات فتكون واطئة، ولذا فان جز كبير من الفسفور الممتز يكون في الجز القابل للتجهيز (Labile – Form) . بتعبير نسبي الترب الحامضية تمتز مرتين فسفور اكثر لكل وحدة مساحة سطح تربة مما هو عليه في الترب الكلسية او المتعادلة و بقوة ربط اعلى خمس م ا رت)علي واحمد 2000 )
عمليات الامتزاز والترسيب هذه تؤثر بشكل كبير في ادارة الاسمدة الفوسفاتية ابتداءً من اختيار السماد الفوسفاتي وطرائق اضافته وتجزئة الاضافة لاسيما في الترب ذات القابلية التثبيتية العالية للفسفور.
اما الفسفور العضوي في التربة فهو جزء من المادة العضوية في التربة ، ويشكل حوالي 3-1 % منها ، ويتواجد في الطبقات السطحية للتربة ، ويجب ان يتمعدن قبل ان يستطيع النبات الاستفادة منه ، وعموما تكون النسب بين S : P : N : C بحدود: 140: 10 : 1.3: 1.3. معظم الفسفور العضوي يكون بشكل استرات الاورثوفوسفات متضمنا الانستول فوسفيت والفوسفوليبيدات والاحماض النووية.
عملية المعدنة تشبه معدنة النتروجين وتتم بمساعدة انزيم الفوسفتيز ووجود الاحياء المجهرية المختلفة، ونسبة P : C ممكن ان تكون دليل للمعدنة او التثبيت، ويمكن توضيح ذلك كما يأتي:-

وعموماً العوامل المؤثرة في نشاط الأحياء من pH وحرارة ورطوبة وعناصر غذائية تؤثر في عملية المعدنة.
العوامل المؤثرة في جاهزية الفسفور:
- معادن الطين : معادن 1:1 اكثر امتزازاَ ومسكاَ للفسفور من معادن 1:2 هذا من حيث النوعية اما من حيث الكمية زيادة كمية المعدن الطيني تزيد من الامتزاز.
- زمن التفاعل : يتحول الفسفور مع الزمن الى الاشكال الاقل ذوباناَ نتيجةَ للامتزاز والترسيب.
- المادة العضوية للتربة: تعمل على تقليل امتزاز الفسفور من خلال الاحماض العضوية تنافس الفسفور على مواقع الامتزاز وتقلل من الامتزاز او الأحماض العضوية تذيب المترسب من الفسفور و الاحماض العضوية تخفض درجة تفاعل التربة pH وتزيد الجاهزية
- درجة تفاعل التربة pH: افضل ذوبانية وجاهزية للفسفور تكون عند المدى 6.8-6.0.
مصادر الاسمدة الفوسفاتية :
هناك عدة مصطلحات للتعبير عن محتوى الفسفور في الاسمدة الفوسفاتية وهي ذائب بالماء WATER SOLUBLE وذائب بالسترات CITRATE SOLUBLE وغير ذائب بالسترات ، وعموما الذائب بالماء يمثل الفسفور المتيسر او الجاهز يسير والذائب بالسترات القابل للتجهيز وغير الذائب او غير جاهز.
عينة صغيرة تستخلص اولا بالماء والمحتوى للفسفور في الراشح يمثل الجزء الذائب بالماء او الفسفور الجاهز بشكل مباشر او المتيسر. المتبقي من الجزء غير الذائب بالماء يستخلص بعياري من سترات الامونيوم القاعدي لتقدير الفسفور الذائب بالسترات وهذا يمثل الفسفور الجاهز او القابل للتجهيز . الفسفور الذائب بالماء والذائب بالسترات يمثل الفسفور الجاهز للنبات من الفسفور الكلي والفسفور المتبقي هو الفسفور غير الذائب، والمجموع الكلي للفسفور الذائب + غير الذائب يمثل الفسفور الكلي المعدني.
الاسمدة الفوسفاتية التجارية:
من بين المعادن العديدة للفسفور في التربة فان معدن الأبتايت الناري والفوسفورايت الرسوبي هي الاكثر استخداماَ في تصنيع الاسمدة الفوسفاتية. الابتايت عبارة عن معدن ناري يتواجد في الصخور التي تكونت منها الترب. اما الفوسفورايت فانه عبارة عن معدنة هياكل الحيوانات عبر العصور الجيولوجية .الابتايت يكون بلوري او كامل التبلور اما الفوسفورايت يكون جز منه متبلور والاخر غير كامل التبلور.
* الصخر الفوسفاتي Roak Phosphate (RP):
مادة خام اولية للأسمدة الفوسفاتية. الترسبات الرئيسة للصخور الفوسفاتية تتواجد في
الولايات المتحدة الاميركية والمغرب والصين وروسيا ، وفي العراق هناك كمية كبيرة ايضا من الصخور الفوسفاتية متمركزة في منطقة عكاشات في قضاء القائم –محافظة الانبار (الرمادي). معادن الصخور الفوسفاتية هي الاباتايت Ca10(PO4)6X2 والذي فيه X يمثل -OH أو -F أو -Cl. الفلورو اباتايت Ca10(PO4)6F2 او Ca3(PO4)2]3.CaF2] من الصخور الفوسفاتية الاكثر انتشارا، هذه الصخور تحوي شوائب من الكاربونات والصوديوم والمغنيسيوم .القيمة السمادية للصخر الفوسفاتي تعتمد على اصل الصخر ومدى صلابته ودرجة تبلوره. وبشكل عام الصخر الصلب اقل جاهزية او عديم الجاهزية .وبشكل عام القيمة للصخر كسماد ممكن في الترب الحامضية ويعتمد على نوع المحصول والصخر والظروف المناخية. وفي الترب القاعدية والمتعادلة يفضل او بالأحرى يجب اضافة الكبريت او اي مادة ذات تأثير حامضي مع الصخر الفوسفاتي ليكون ذا فائدة (الاعظمي 1990).
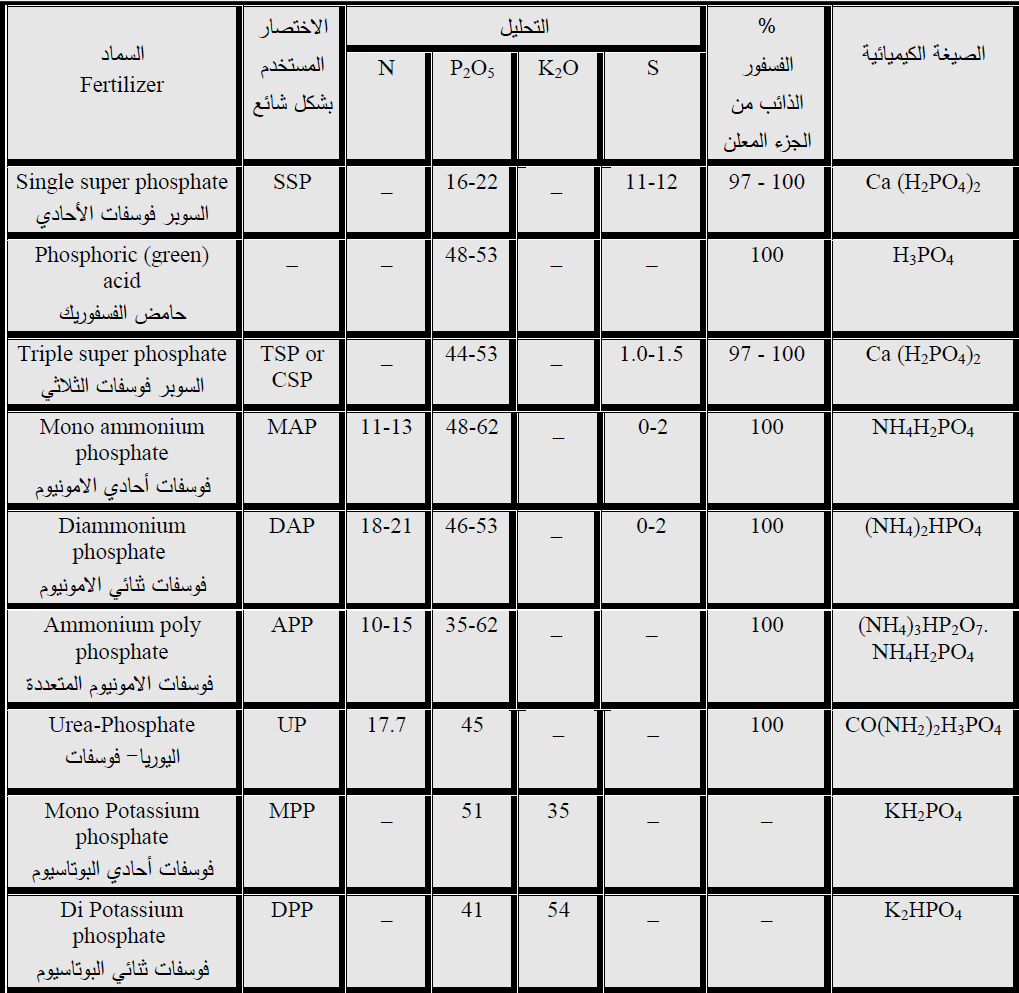
الاسمدة الفوسفاتية المعدنية الشائعة الاستعمال تصنع من الصخور الفوسفاتية بعد معاملة هذه الصخور بالحوامض والحرارة لزيادة تركيز الفسفور الذائب بالماء (جدول 1).
حامض الفسفوريك:
حامض الفسفوريك (H3PO4) او الحامض الاخضر ، يحوي 17 – 24 % P او (P2O5 %55 – 39) وينتج من تفاعل RP مع H2SO4 وينتج من التفاعل الجيبس الذي من الممكن ان يستعمل مصلحاَ او سماداَ كبريتياَ لاسيما في الترب القاعدية .هذا الحامض يمكن تصنعه من خلال تسخين الصخر الفوسفاتي في مرمدة كهربائية (Electric Furnace Muffle Furnace) لإنتاج عنصر الفسفور والذي يتم تفاعله مع الماء والاوكسجين لتكوين H3PO4 .المنتج من خلال عملية الحرق يطلق عليه الفسفور الابيض او حامض المرمدة وينتج بشكل رئيس للاستعمالات الاخرى غير الزراعية. وهذا الحامض له درجة عالية من النقاوة وهو غالي الثمن .الحامض الاخضر المخصص للزراعة يستعمل لتحميض الصخر الفوسفاتي لصناعة الاسمدة الفوسفاتية المختلفة .هذا الحامض يمكن ان يحقن مع الماء او يحقن في التربة لاسيما في الترب القاعدية والكلسية.
جدول 1 : بعض الاسمدة الفوسفاتية شائعة الاستعمال
* فوسفات الكالسيوم:
اسمدة فوسفات الكالسيوم: -
وهذه الاسمدة تشمل :السوبر فوسفات الاعتيادي و السوبر فوسفات الثلاثي. هذه المصادر كانت هي الاكثر اهمية بالاستعمال، اما في الوقت الحاضر فهناك مصادر اخرى تنافس هذه المصادر . عموما هذه الاسمدة ليست لها تأثير واضح في درجة تفاعل التربة .
- السوبر فوسفات الاعتيادي او يسمى السوبر فوسفات المفرد Phosphate (SSP) or (OSP) Single Super
يصنع هذا السماد من تفاعل الصخر الفوسفاتي مع حامض الكبريتيك:-
Ca3(PO4)2]3.CaF2 + 7H2SO4 -----˃ 3Ca(H2PO4)2+ 7CaSO4+ 2HF
اذ يتم معاملة الصخر الفوسفاتي المطحون بشكل ناعم مع الكمية والتركيز المناسب من حامض الكبريتيك (57% على الاقل). هذا السماد يحوي على 22-11% P2O5 ، (P 9.6-4.8)وهو مصدر ممتاز للفسفور والكبريت (12% S)، وعلى الرغم من انخفاض مستوى الفسفور فيه مما حدد من استعماله الا انه يبقى مصدراَ جيد اَ للكبريت والفسفور ولكن على نطاق محدود .الفسفور الذائب بالماء يمثل اكثر من 90 % من الفسفور المعلن (من نسبة الفسفور في السماد). وينتج حامض الفسفوريك
ايضاَ وهو سبب عدم تكون الجبس وتكون كبريتات الكالسيوم غير المائية.عموماَ السوبر فوسفات الاعتيادي يحوي على MCP + DCPD +حامض الفسفوريك الحر . MCP + حامض الفسفوريك الحر تشكل بحدود 75 - 90% من الفسفور والباقي 10 - 25% DCPD وكمية قليلة من TCP .
- السوبر فوسفات الثلاثي او المركز (Triple Super Phosphate (Concentrated
يحوي هذا السماد على 52-44% P2O5 ويصنع كما في المعادلة الاتية :
[Ca3(PO4)2]3.CaF2 +14 H3PO4 +10H2O---˃10Ca(H2PO4)2. H2O + 2HF
وهو مصدر عالي المحتوى من الفسفور وكمية الكبريت فيه لا تتجاوز 1% وهذا المصدر الاكثر استخداما في الولايات المتحدة وعالميا حتى عام 1960 عندما بدأ سماد فوسفات الامونيوم بالانتشار والمنافسة. وهو يصنع بأشكال حبيبية وغير حبيبية ، ويستخدم للمزج مع الاسمدة الاخرى او الاضافة المباشرة للتربة. وهذا السماد يصنع في الع ا رق بشكل واسع في منشأة الاسمدة الفوسفاتية في عكاشات /العراق.
وهناك دراسات عدة على المستوى العالمي وعلى مستوى القطر اثبتت نجاع هذا السماد واستجابة المحاصيل المختلفة لإضافته لاسيما المحاصيل التي تحتاج الى الكالسيوم و في الترب الحامضية والحقيقة حتى في الترب الكلسية. حبيبة السماد عند ذوبانها تكون ذات pH منخفض جدا ولكن لفترة قصيرة وينتهي التأثير بمجرد التفاعل في التربة المحيطة ، والتأثير النهائي اما متعادل او بالاتجاه القاعدي لاسيما ان الترب الع ا رقية ذات سعة بفرية عالية.
وبشكل عام السوبرفوسفات يكون اما بشكل مسحوق (باودر) او بشكل حبيبي او اصابع Pelletized والحبيبي بحجم 1-4 ملمتر قطراَ هي المفضلة وذلك لتقليل اسطح التلامس مع اسطح الامتزاز وبالتالي تقليل الامتزاز والترسيب كما ان الاضافة الموقعية للفسفور مفضلة على الاضافة نثراَ. الحبيبي يصنع من ترطيب السماد المسحوق ومن ثم تجفيفه في براميل التجفيف. الحبيبي مع انه اغلى ثمناَ الا انه افضل بالتعبئة والنقل والاضافة.
* فوسفات الامونيوم: Ammonium Phosphate
هذه الاسمدة تنتج من تفاعل حامض الفسفوريك مع الامونيا . وهي من الاسمدة المركبة وفقاَ للتصنيف الحديث وتشمل:
- فوسفات احادي الامونيوم او فوسفات الامونيوم الاحادية (MAP) Mono ammonium phosphate
يحوي هذا السماد على 11% N و 55-48% P2O5 (P% 21 – 24) وهو سماد ذائب بالماء 100%.
4NH3 + H3PO4 ----˃ NH4H2PO
يضاف هذا السماد مباشرة للتربة بهيئته المصنعة على شكل حبيبات وقد يصنع بهيئة سائلة ويضاف مع ما الري .تفاعله مع التربة حامضي ، ووجود الامونيوم معه يتطلب الاهتمام بموضوع اضافة الماء وعدم اضافة السماد قرب البذور، مع ان تفاعله الحامضي يقلل من موضوع تحول الامونيوم الى الامونيا، أي بتعبير آخر الخوف من التطاير اقل مقارنة بالد DAP.
- فوسفات ثنائي الامونيوم (فوسفات الامونيوم الثنائية Di ammonium phosphate ) (DAP)
وهو يصنع من الامونيا مع حامض الفسفوريك
2NH3 + H3PO4 ---˃ (NH4)2HPO4
سماد ذائب بالماء 100 % ويحوي على 18 % N و 53-46% P2O5 P % 23-20))
.هذا السماد يعد السماد الاكثر انتشارا في الولايات المتحدة وينافس الاسمدة الاخرى حتى ال MAP.
وعلى الرغم من ان تفاعله قاعدي ، وهناك خوف من موضوع تطاير الامونيا وتأثيرها على النباتات الصغيرة وعلى الإنبات، إلا أن احتواءه على N , P وبمستويات جيدة جدا جعلته سماد مركب P N وينافس الاسمدة الاخرى. هذا السماد يصنع على مستوى عالي في الاردن ، وهو الان منافس جيد لبقية الاسمدة في العراق الا انه غالي الثمن لكونه مستورد، وهناك سماد عراقي ولكن مواصفاته ليس بمستوى السماد الاردني .كلا السمادين الد MAP و DAP ذائبة 100% بالماء، والمقصود هنا الذائب للجزء المعلن أي من الفسفور الموجود فيه ولكن هناك شوائب لأنه تجاري وليس للتحاليل.
اما المختبري او المخصص للتحاليل فذوبانيته 100% بدون شوائب ، لذا يجب الانتباه عند استعمالها لموضوع الرش او مع مياه الري (الري بالتنقيط).
المحتوى العالي من P و N يقلل كلفة الشحن والخزن والاضافة. ويمكن ان تستعمل هذه الاسمدة لتصنيع الاسمدة المركبة والمخلوطة .عند اضافة ال DAP بشكل قريب من البذور ممكن ان يؤذي او يضر الباد ا رت ويثبط نمو الجذور من خلال الامونيا المنتجة طبقا للآتي:
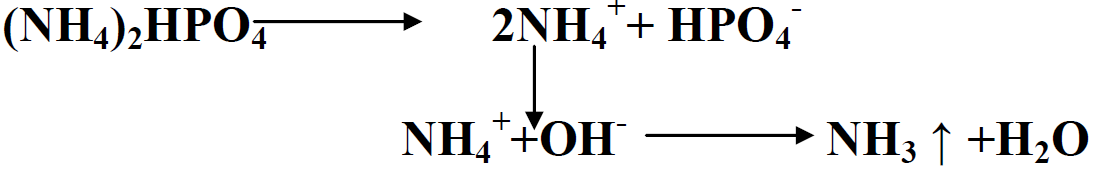
هذه المشاكل شائعة في الترب الكلسية وذات الد pH المرتفع. اضافة ال DAP بمسافة عن البذور ضرورية لتقليل الضرر .في كل الاحوال مستوى N يجب ان لا يتجاوز 20-15 كغم . هـ-1 .التأثير بالMAP اقل الا انه يحصل مع المحاصيل الحساسة مثل السلجم والكتان .هذا اضافة الى ان ال DAP عند اذابته يكون ذا pH قاعدي بحدود 8.5 مما يشجع انتاج الامونيا .التفاعل الحامضي لل MAP في التربة اعتبر على انه يشجع تحرر العناصر الصغرى، الا ان هذه النتيجة ليست واضحة وثابتة. عموما الفروق بين ال MAP و DAP بالتطبيق ليست كبيرة وعلى العكس هناك دراسات اثبتت افضلية ال DAP على ال MAP وعلى السوبر فوسفات .
* فوسفات الامونيوم المتعددة : Ammonium Poly Phosphate
يصنع بمعاملة البايروفوسفات H4P2O7 مع الامونيا. حامض البايروفوسفات ينتج من ازالة الماء من حامض الفوسفوريك المنتج بالطريقة الرطبة .البولي فوسفات مصطلح يضيف آيونين او اكثر من الاورثوفوسفات H2PO4 جمعت سوية مع فقدان جزيئة ما واحدة لايونين من الاورثوفوسفات وفقاَ للمعادلة الاتية:
3NH3 +H4P2O7 ----˃(NH4)3HP2O7
البولي فوسفات يتعرض الى تفاعلات كيميائية وحيوية منتجا -H2PO4 . التحلل المائي للبولي فوسفات يكون بطيئاَ في المحاليل المعقمة عند درجة حرارة الغرفة، ومع هذا في الترب التي تعمل فيها الاليتان الكيميائية والحيوية، التحلل المائي يكون سريع للبولي فوسفات، وهي تتأثر بأحياء الرايزوسفير وانزيم الفوسفيتيز ، وبما انها تمتلك جزاَ حيوياَ .. اذن التأثير بالعوامل البيئية مهم ولاسيما درجة الحرارة (الحرارة المثلى 35-5 °م). المحاصيل تستطيع امتصاص البولي فوسفات مباشرة وهي ذات قابلية جيدة على خلب العناصر الصغرى مثل الزنك ، الا ان الخلب وقتي لحين التحلل ..
فوسفات البوتاسيوم : Potassium Phosphate
هذه المنتجات تتضمن K2HPO4 و K2HPO4 وهي مركبات ذائبة بالماء، وتستخدم بشكل واسع في المحاصيل البستنية .احتواءها من P و K العالي جعلها مواد جذابة ، وهي مثالية للعائلة
الباذنجانية الطماطة والبطاطا ومحاصيل الخضر الورقية الحساسة للكلور المتواجد في سماد كلوريد البوتاسيوم. دليلها الملحي الواطئ يقلل من اثرها السلبي على البذور النابتة والبادرات اليافعة عندما توضع هذه الاسمدة قريبة او عند البذور. الاختلاف بالنسبة للجاهزية بين المصادر المختلفة للأسمدة الفوسفاتية قليل مقارنة بعوامل الادارة الاخرى للفسفور مثل معدل الاضافة و طريقة الاضافة.
التسميد الفوسفاتي الحيوي أو الميكروبي
PHOSPHATE SOLUBILIZING BACILLI OR MICROBIAL P FERTILIZATION.( BIOFERTILIZER)
الاحياء المذيبة للفوسفات او الرايزوبكتريا الاخرى المتوافرة في التربة بكثرة ممكن ان تعزل من المحيط الجذري للنبات (الرايزوسفير) اذ ان الرايزوبكتريا معروفة في انها تستعمر جذور النباتات وتحفز النبات وتسمى (PGPB) PLANT GROWTH PROMOTING BACTERIA أي بكتريا محفزة لنمو النبات ، وهناك دراسات تبين ان هذه الاحياء تذيب معادن الفوسفات الاصلية وصخر الفوسفات، والتأثير يتأتى من تحرر الاحماض العضوية او مواد مخلبية وهناك لقاحات تجارية في كندا واستراليا لإذابة الفسفور واثبتت نجاحها.
تداخل النتروجين مع الفسفور:
النتروجين يحفز ويشجع امتصاص الفسفور بوساطة جذور النبات من خلال:-
- زيادة نمو الجزء العلوي والجذور.
- تغير البناء الحيوي للنبات.
- زيادة ذوبانية وجاهزية الفسفور.
وهنا الامونيوم يكون له تأثير اكبر من خلال دوره في خفض ال pH وتشجيع الامتصاص.
حجم حبيبة السماد الفوسفاتي:
لحجم الحبيبة والذوبانية بالماء دور مهم في تفاعل الفسفور في التربة ، وعموما كلما قل التماس بين التربة والسماد يؤدي الى تحسن في جاهزية الفسفور .
كذلك الاضافة تلقيما او الاضافة الموقعية تكون اكثر كفا ة من النثر والخلط مع التربة (وذلك نتيجةَ لتقليل اسطح التماس ومن ثم تقليل الامتزاز).
الفسفور المتبقي:
بشكل عام الجاهزية للفسفور المتبقي ممكن ان تبقى لمدة سنين اعتماداَ على مستوى السماد المضاف وامتصاص الفسفور من قبل المحصول و خواص التربة المؤثرة في كيميا الفسفور .ومع هذا وبشكل عام ، الجاهزية تبقى لفترة اطول في الترب الكلسية والضعيفة التجوية مقارنة بالترب الحامضية والمجواة.
الحد الحرج للفسفور وللترب الكلسية بحدود (25-15 جز بالمليون) (25-15 ملغم.كغم-1 تربة)، ومع هذا هناك اختلاف حسب التربة وحسب المحصول.
المهم هو اجراء فحص تربة لتقدير محتوى التربة من الفسفور الجاهز وبطريقة جيدة ل وصف هذه الكمية الجاهزة قبل اضافة الفسفور . ومع هذا وحتى لو كان مستوى الفسفور جيد فهناك دراسات عدة اثبتت ان اضافة ابتدائية للسماد الفوسفاتي تشجع وتعظم من الانتاج لاسيما وان دراسات حركيات الفسفور اثبتت بطء الامتصاص والحركة في التربة مما يستوجب الاضافة لتلبية الاحتياجات السريعة .



|
|
|
|
"عادة ليلية" قد تكون المفتاح للوقاية من الخرف
|
|
|
|
|
|
|
ممتص الصدمات: طريقة عمله وأهميته وأبرز علامات تلفه
|
|
|
|
|
|
|
المجمع العلمي للقرآن الكريم يقيم جلسة حوارية لطلبة جامعة الكوفة
|
|
|