
SN1 Reaction: The Substrate
 المؤلف:
John McMurry
المؤلف:
John McMurry
 المصدر:
Organic Chemistry
المصدر:
Organic Chemistry
 الجزء والصفحة:
9th. p 327
الجزء والصفحة:
9th. p 327
 30-5-2017
30-5-2017
 3232
3232
SN1 Reaction: The Substrate
According to the Hammond postulate any factor that stabilizes a high-energy intermediate also stabilizes the transition state leading to that intermediate. Since the rate-limiting step in an SN1 reaction is the spontaneous, unimolecular dissociation of the substrate to yield a carbocation, the reaction is favored whenever a stabilized carbocation intermediate is formed.
The more stable the carbocation intermediate, the faster the SN1 reaction. The stability order of alkyl carbocations is 3° > 2°>1° > methyl. To this list we must also add the resonance-stabilized allyl and benzyl cations. Just as allylic radicals are unusually stable because the unpaired electron can be delocalized over an extended π orbital system so allylic and benzylic carbocations are unusually stable. (The word benzylic means “next to an aromatic ring.”) As Figure 1.1 indicates, an allylic cation has two resonance forms. In one form, the double bond is on the “left”; in the other form it’s on the “right.” A benzylic cation has five resonance forms, all of which contribute to the overall resonance hybrid.

Figure 1.1 Resonance forms of allylic and benzylic carbocations. The positive charge is delocalized over the π system in both. Electron-poor atoms are indicated by blue arrows. Because of resonance stabilization, a primary allylic or benzylic carbocation is about as stable as a secondary alkyl carbocation, and a secondary allylic or benzylic carbocation is about as stable as a tertiary alkyl carbocation.
This stability order of carbocations is the same as the order of SN1 reactivity for alkyl halides and tosylates.

We should also note parenthetically that primary allylic and benzylic substrates are particularly reactive in SN2 reactions as well as in SN1 reactions.
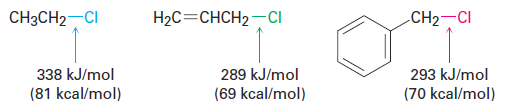
Allylic and benzylic C - X bonds are about 50 kJ/mol (12 kcal/mol) weaker than the corresponding saturated bonds and are therefore more easily broken.
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


