علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
sp Hybrid Orbitals and the Structure of Acetylene
المؤلف:
John McMurry
المصدر:
Organic Chemistry
الجزء والصفحة:
9Th. p17
7-2-2016
3836
sp Hybrid Orbitals and the Structure of Acetylene
In addition to forming single and double bonds by sharing two and four electrons, respectively, carbon also can form a triple bond by sharing six electrons. To account for the triple bond in a molecule such as acetylene, H-C≡C-H, we need a third kind of hybrid orbital, an sp hybrid. Imagine that, instead of combining with two or three p orbitals, a carbon 2s orbital hybridizes with only a single p orbital. Two sp hybrid orbitals result, and two p orbitals remain unchanged. The two sp orbitals are oriented 180°apart on the x-axis, while the p orbitals are perpendicular on the y-axis and the z-axis, as shown in Figure 1.

Figure 1 sp Hybridization. The two sp hybrid orbitals are oriented 180° away from each other, perpendicular to the two remaining p orbitals (red/blue).
When two sp-hybridized carbon atoms approach each other, sp hybrid orbitals on each carbon overlap head-on to form a strong sp–sp s bond. At the same time, the pz orbitals from each carbon form a pz–pz π bond by sideways overlap, and the py orbitals overlap similarly to form a py–py π bond. The net effect is the sharing of six electrons and formation of a carbon–carbon triple bond. The two remaining sp hybrid orbitals each form a s bond with hydrogen to complete the acetylene molecule (Figure 2).
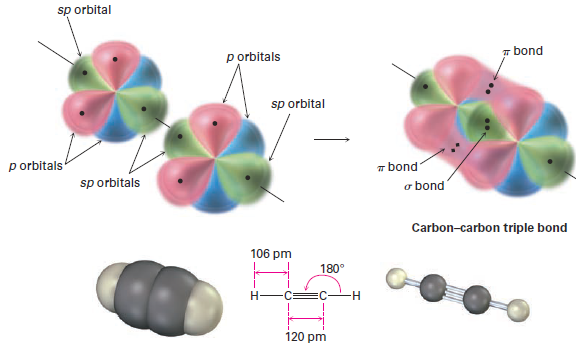
Figure 2 the structure of acetylene. The two carbon atoms are joined by one sp–sp σ bond and two p–p π bonds.
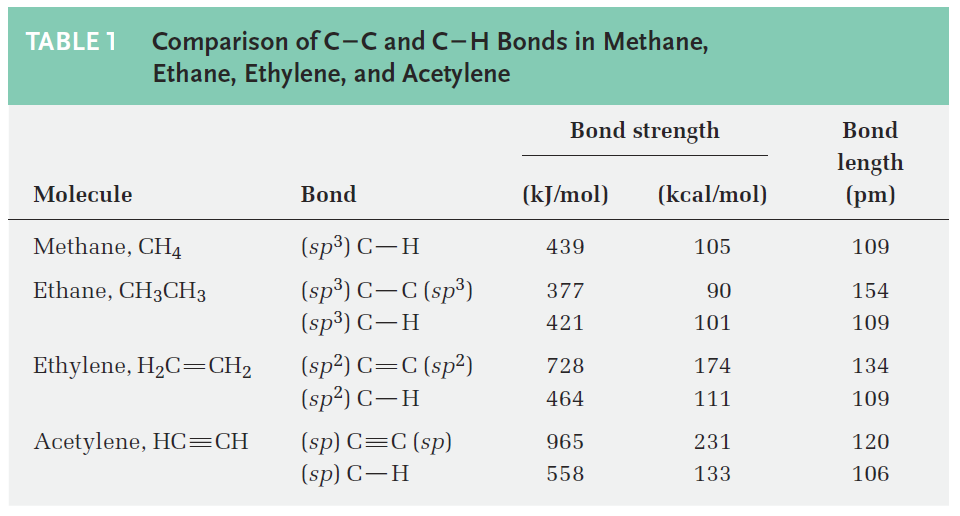
As suggested by sp hybridization, acetylene is a linear molecule with H--C-C bond angles of 180°. The C- H bonds have a length of 106 pm and a strength of 558 kJ/mol (133 kcal/mol). The C-C bond length in acetylene is 120 pm, and its strength is about 965 kJ/mol (231 kcal/mol), making it the shortest and strongest of any carbon–carbon bond. A comparison of sp, sp2, and sp3 hybridization is given in Table 1.
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)