
تعین (أو تمییز) نقطة النهایة في معایرات الأكسدة والاختزال
 المؤلف:
م.مسعود فرج ابو ستة
المؤلف:
م.مسعود فرج ابو ستة
 المصدر:
تجارب في الكيمياء التحليلية (التحليل الكمي الحجمي والوزني )
المصدر:
تجارب في الكيمياء التحليلية (التحليل الكمي الحجمي والوزني )
 الجزء والصفحة:
ص103
الجزء والصفحة:
ص103
 25-1-2016
25-1-2016
 1603
1603
تعین (أو تمییز) نقطة النهایة في معایرات الأكسدة والاختزال
یتم تمییز نقطة النهایة في معایرات الأكسدة والاختزال عن طریق قیاس جهد المحلول بأستخدام قطب مناسب ومن ثم رسم هذا الجهد مع حجم المحلول المعایر (المحلول المضاف) ولكن ،كما هو الحال في المعایرات الأخرى من الأفضل والأنسب أستخدام الدلائل البصریة،وهي ماتعرف بأدلة معایرات الاكسدة و الاختزال والتي یمكن تقسیمها الي الأتي:
وهي عبارة عن مواد اكسدة او اختزال یتغیر لونها عند نقطة التكافؤ و هذه المواد تعد نفسها دلیلاً كما في حالة برمنجانات البوتاسیوم (KMnO4) حیث یزول لونها عند المعایرة وقبل نقطة التكافؤ، نتیجة اختزالها إلى المنجنیز الثنائي Mn+2 ولكن بإضافة قطرة زائدة بعد نقطة التكافؤ یتلون المحلول بلون قرمزي واضح (وردي خفیف) وهو لون البرمنجانات .
الدلائل الخاصة:
وهي عبارة عن مركبات كیمیائیة تتفاعل مع أحدى مواد المعایرة بصورة خاصة ومن أمثلتها دلیل النشأ الذي یكون معقداً أزرق مع الیود ویختفي اللون باختفاء الیود ویعود اللون بعودة الیود ،كما یسلك أیون الثایوسیانات SCN- كدلیل خاص في معایرة الحدید الثلاثي (الحدیدیك) حیث یكون (SCN- ) مركباً معقداً أحمر اللون مع الحدید الثلاثي ویختفي اللون باختفاء الحدید الثلاثي نتیجة لاختزاله إلى الحدید الثنائي (الحدیدوز).
دلائل التأكسد والاختزال الحقیقیة:
وهي عبارة عن مركبات عضویة یختلف لونها في الصورة المتأكسدة عن لونها في الصورة المختزلة كما هو الحال في دلائل التعادل ویتغیر لون الدلیل تبعاً لتغیر الجهد.
In(OX) + e ⟶ In(Red)
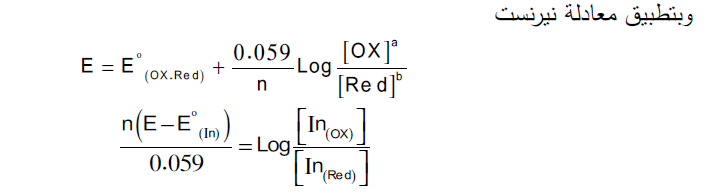

من ترتیب المعادلة السابقة یتبین أن نسبة تركیب اللونین یتغیر بتغیر الجهد،وبما أن العین البشریة تستطیع التمیز بین لونین إذا كانت النسبة بینها ( 10:1 ) لهذا فعند تعویض هذه النسبة أو مقلوبها في المعادلة السابقة نحصل على ما یلي:

ولغرض اختیار الدلیل المناسب لأیة عملیة معایرة تأكسد اختزال لابد من توفر شرطین
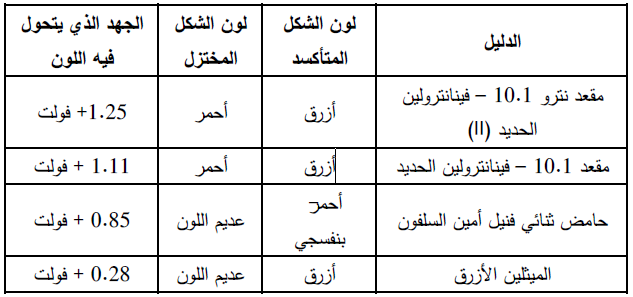
معرفة جهد القطب الدلیل القیاسي EoIn والجدول ادناه یوضح الجهد القیاسي لبعض الدلائل
معرفة جهد التفاعل E عند نقطة التكافؤ

 الاكثر قراءة في التحليل النوعي والكمي
الاكثر قراءة في التحليل النوعي والكمي
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


