

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
العلاقة بين الكتلة والطاقة
المؤلف:
د.عائشة محمود التركستاني
المصدر:
الكيمياء النووية والإشعاعية
الجزء والصفحة:
ص21
27-11-2015
18314
العلاقة بين الكتلة والطاقة
يستخدم علم الكيمياء النووية وحدة دولية لقياس الطاقة هي وحدة الإلكترون فولت ev ، وترتبط هذه الوحدة بوحدة الطاقة النظامية الجول بالعلاقة الآتية:
1 ev = 1.6x10-19 Joule
مقدار الطاقة هذا صغير جدا لذلك غالبا ما تستخدم مضاعفات هذه الوحدة وهي:
- كيلو إلكترون فولت (Kev) = 103 إلكترون فولت.
- ميجا (مليون) إلكترون فولت (Mev) = 106 إلكترون فولت.
- جيجا (بليون) إلكترون فولت (Gev) = 199 إلكترون فولت.
في عام 1904 م توصل أينشتاين Einstein إلى علاقة تربط الطاقة والكتلة وإستنتج فيها أن كتلة الجسيم في الواقع هي مقياس لما يحتويه من طاقة. فإذا فقد الجسم بعضا من طاقته نقصت كتلته بكمية تتناسب مع هذا النقص تبعا للمعادلة:
E = m x C2
هذه العلاقة تنطبق على جميع أنواع الطاقة وليس على طاقة الحركة فقط، مما يعني أننا نستطيع أن نستخدمها لحساب الطاقة المتولدة في التفاعلات النووية، حيث لوحظ أن أي تفاعل تحلل نووي يكون مصحوبا بنقص في كتلة الأنوية الأم مقارنة بكتل الأنوية الوليدة، وهذا ما يجعل العلاقة السابقة كالآتي:
ΔE = Δm₀ C2
حيث أن Δm₀ هي التغير في الكتلة الساكنة، C هي سرعة الضوء و ΔE هي كمية الطاقة النطلقة بعد حدوث التحلل . ولما كانت سرعة الضوء كبيرة وتساوي 3x1010 سم/ ثانية فإن مقدارا ضئيلا من المادة يتحول إلى قدر هائل من الطاقة.
حيث أوضح أينشتاين في النظرية النسبية أن كتلة الجسم تتغير بتغير سرعته وعندما تصل سرعة الجسم إلى سرعة الضوء فإن الكتلة يجب أن تؤول إلى الصفر.
ويمكن حساب الطاقة المصاحبة لوحدة الكتلة في الذرة والتي تساوي 1.66x10-24 جم بأنها تساوي =
(1.6x10-12) / ((3x1010) x (1.66x10-24)) = 931 مليون إلكترون فولت (Mev) .
نلاحظ أن الطاقة المنطلقة (المكافئة) لتغير صغير في الكتلة تكون كبيرة جدا ولا يمكن قياسه بأي نوع من الزوازين، لذلك تهمل معادلة آينشتاين في التفاعلات الكيميائية ولكن تتضح أهميتها في الكيمياء النووية.
وتقاس أوزان الذرات أو النوى منسوبة إلى وزن نظير الكربون 12 ، حيث تعتبر كتلة هذا النظير مساوية 12.000 وحدة كتلة ذرية، وهي تكافئ 1.66x10-24 جم. ومن المتبع في التفاعلات النووية إستخدام وحدات الإلكترون فولت (ev) أو المليون إلكترون فولت (Mev) كوحدات لقياس الطاقة وتحسب الطاقة لكل ذرة بدلا من المول في التفاعلات الكيميائية.
ويعرف الإلكترون فولت بأنه كمية الطاقة التي يكتسبها الإلكترون إذا تحرك تحت تأثير فرق جهد يساوي 1 فولت، وحيث أن شحنة الإلكترون = 4.8029x10-10 وحدة كهروستاتيكية وأن الفولت = 1/300 وحدة كهروستاتيكية.
إذا الإلكترون فولت = 106 مليون إلكترون فولت.
ولقد تم حساب متوسط طاقة الربط لكل نيوكلون للعناصر المختلفة وإستخدامها كمقياس متناسب لمدى الإستقرار النووي.
ويوضح الشكل ادناه العلاقة بين طاقة الربط لكل نيوكلون والعدد الوزني للعناصر المختلفة. حيث يوضح المنحنى أن طاقة الربط للنواة الخفيفة 2H صغيرة جدا وهذا يدل على عدم إستقرار هذه الأنوية. وتزداد قيمة ΔE/A إلى أن تصل قيمة عالية حوالي 8.8 مليون إلكترون فولت عند النويدات ذات وزن ذري 50 وبعدها تقل قيمة طاقة الربط كلما زاد الوزن الذري لتصل إلى 7.6 لليورانيوم (نواة غير مستقرة).
متوسط طاقة الربط لكل نيوكلون = طاقة الربط الكلية / العدد الوزني ΔE / A
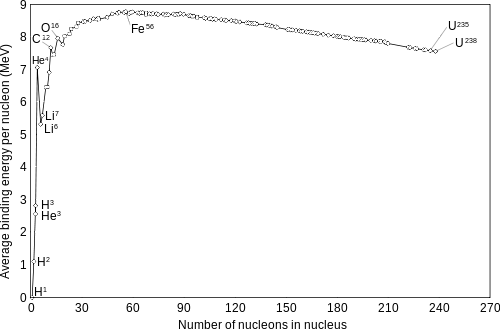

منحنى طاقة الربط لكل نيوكليون للأنوية المستقرة كدالة لعدد الكتلة
ومن المنحنى نجد أيضا أن طاقة الربط للأنوية التالية: 16O, 12C, 4He أعلى من العناصر التي تجاورها وذلك لأنها أنوية مستقرة. وعلى ذلك فإن طاقة الربط لكل نيوكلون تعطي معلومات عن درجة ثبات النواة.
ويستنتج من ذلك أنه لو دمجت نواتا ذرتين خفيفتين فإن النواة الناتجة تكون أكثر إستقرارا إلا أنه يفقد مقدار من الكتلة (نتيجة لعملية الدمج هذه) رغم أن
لنواة الجديدة تشمل مجموع محتويات النواتين، ويتحول المقدار المفقود من الكتلة إلى طاقة منتشرة وهذا ما يحدث في عملية الإندماج النووي Nuclear Fusion مثل:
73Li + 11H 2 42He + Energy
21H + 31H 42He + P + 18.35 Mev
كذلك يصحب إنشطار نواة ذات كتلة كبيرة إلى نواتين أو أكثر وتسمى هذه العملية بالإنشطار النووي Nuclear Fission
 الاكثر قراءة في الكيمياء الاشعاعية والنووية
الاكثر قراءة في الكيمياء الاشعاعية والنووية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















