
Atomic Energy States and Line Spectra
 المؤلف:
John D. Roberts and Marjorie C. Caserio
المؤلف:
John D. Roberts and Marjorie C. Caserio
 المصدر:
Basic Principles of Organic Chemistry : LibreTexts project
المصدر:
Basic Principles of Organic Chemistry : LibreTexts project
 الجزء والصفحة:
........
الجزء والصفحة:
........
 9-1-2022
9-1-2022
 2604
2604
Atomic Energy States and Line Spectra
The energies of the hydrogenlike orbitals of various atoms were mentioned in Chapter 6 and, in particular, we showed a diagram of the most stable state (1s)2(2s)2(2p)2 of a carbon atom (Figure 6-4). Transfer of one of the 2p electrons to the 3s orbital requires excitation of the atom to a higher energy state and this can be achieved by absorption of electromagnetic radiation of the proper wavelength. The usual way that such excitation occurs is by absorption of a single quantum of radiant energy, and we can say that the absorption of this amount of energy ΔE12, corresponds to excitation of the atom from the ground state with energy E1 to an excited state of configuration (1s)2(2s)2(2p)1(3s)1 and energy E2:
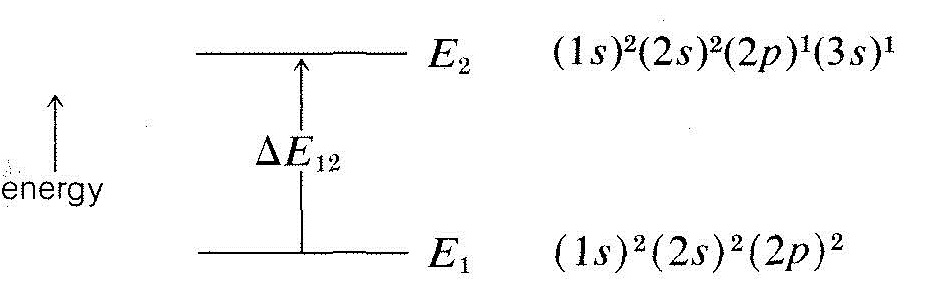
The difference in energy, ΔE12, is related directly to the frequency (ν, sec−1) or wavelength (λ, nm) of the absorbed quantum of radiation by the equation

in which hh is Planck's constant and c is the velocity of light. The relationship ΔE=hνΔ often is called the Bohr frequency condition.
For chemical reactions, we usually express energy changes in kcal mol−1. For absorption of one quantum of radiation by each atom (or each molecule) in one mole, the energy change is related to λ by

As defined, ΔE12 corresponds to one einstein of radiation.
What we have developed here is the idea of a spectroscopic change being related to a change in energy associated with the absorption of a quantum of energy. Spectra are the result of searches for such absorptions over a range of wavelengths (or frequencies). If one determines and plots the degree of absorption by a monoatomic gas such as sodium vapor as a function of wavelength, a series of very sharp absorption bands or lines are observed, hence the name line spectra. The lines are sharp because they correspond to specific changes in electronic configuration without complication from other possible energy changes.
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


