
الباهاء (pH) هي القيمة السالبة للوغاريتم تركيز أيونات لهيدروجين
 المؤلف:
د. روبرت موراي وآخرون
المؤلف:
د. روبرت موراي وآخرون
 المصدر:
هاربرز في الكيمياء الحيوية
المصدر:
هاربرز في الكيمياء الحيوية
 الجزء والصفحة:
ص 59
الجزء والصفحة:
ص 59
 31-3-2021
31-3-2021
 5327
5327
الباهاء (pH) هي القيمة السالبة للوغاريتم تركيز أيونات لهيدروجين
دخل مصطلح الباهاء (pH) عالمتا في العام 1909 ، وكان العالم سورنسن Sorensen هو أول من استخدمه وعرفه على أنه القيمة السالبة للوغاريتم تركيز أيونات الهيدروجين [H+] :
pH = - log [H]
وبالرغم من عدم دقة هذا التعريف ، فإنه كاف لكل أغراض الكيميا الحيوية ولحساب قيمة باهاء (pH) محلول ما نقوم بما يلي :
1- حساب تركيز أيونات الهيدروجين ، أي [+[H
2- حساب اللوغاريتم العشري لـ [+H].
3- قيمة الباهاء (pH) هي القيمة السالبة لناتج المرحلة 2. فمثلا باهاء (pH) الماء النفي في درجة الحرارة 25 مئوية تساوي :
pH = - log [H+] = - log 10-7 = - (-7) = 7.0
وتتناسب قيمة الباهاء (pH) عكسيا مع تركيز أيونات الهيدروجين، فالقيم المرتفعة للأول تعبر عن القيم المنخفضة للثاني ، كما أن القيم المنخفضة للأول تعبر عن القيم المرتفعة للثاني.
تعرف الأحماض (Acids) على أنها مانحة للبروتونات (Proton donors)، بينما تعرف الأسس (القواعد) (Bases) على أنها مستقبلة للبروتونات Proton) (acceptors؛ لكن يحب التمييز أيضاً بين الأحماض القوية (Strong acids) (كحمض الكبريتيك وحمض الهيدروكلوريك) التي تتفارق (تتأين : Dissociate) بشكل تام إلى أنيونات وكاتيونات حتى في المحاليل الحمضية (باهاء pH منخفضة) وبين الأحماض الضعيفة (Weak acids) التي يبقى تأينها جزيئاً في المحاليل الحمضية. وبنفس الطريقة، يحب التمييز بين الأسس الضعيفة (Weak bases) مثل 2(Ca(OH والأسس القوية (Strong bases) (مثل NaOH و٥c^ ، فهذه الأخيرة هي وحدها التي تستطيع التأين في المحاليل ذات الباهاء (pH) العالية. وفي الواقع، تملك العديد من المركبات الكيميائية الحيوية خاصية الأحماض الضعيفة ، ويستثنى من ذلك المتأيضات المتوسطة المفسفتة (Phosphorylated) التي تملك مجموعة حمض الفوسفوريك الأولية ذات الصفة الحمضية القوية.
وفيما يلي أمثلة عن طريقة حساب باهاء (pH) المحاليل الحمضية والقاعدية : مثال : ما هي قيمة الباهاء (pH) حلول تركيز أيونات الهيدروجين فيه يساوي
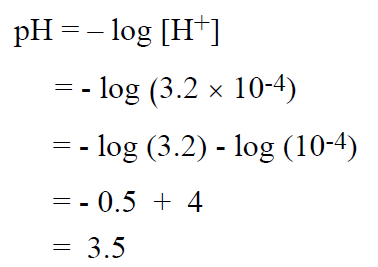
مثال : ما هي قيمة الباهاء (PH) لمحلول تركيز أيونات الهيدروكسيل فيه يساوي 3.2 × 10-4 مول / ل؟
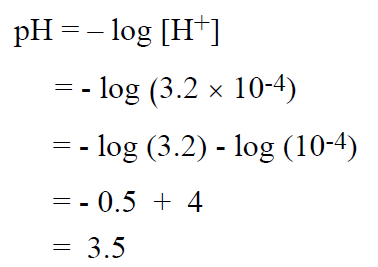
لحل هذه المسألة ، نعرف قيمة POH التي تساوي القيمة السالبة للوغاريتم تركيز ايونات الهيدروكسيل – والتي يمكن اشتقاقها من تعريف ثابتة المنتج الايوني للماء(KW) :
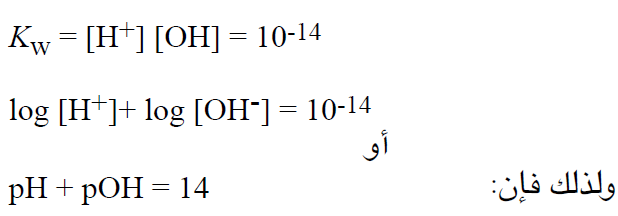
والأن يمكننا حل المسألة السابقة كما يلي:
مثال : احسب قيم الباهاء (pH) للمحلولين التاليين :
(أ) محلول KOH تركيزه 2.0 × 10-2 مول / ل.
(ب) محلول KOH تركيزه 2.0 × 10-6 مول / ل
تأتي أيونات الهيدروكسيل من مصدرين يجب اخذهما بعين الاعتبار وهما KOH والماء، وبينما نستطيع اعتبار مساهمة الماء في مجموع أيونات الهيدروكسيل مهملة في المحلول الأول ، لا يمكن اعتباره كذلك في المحلول الثاني :

وعندما نصل إلى القرار حول أهمية مساهمة الماء، يمكن حساب باهاء (pH) المحلول بالطريقة التي ذكرت اعلاه.
أفترضنا في الامثلة اعلاه ان KOH تأين بكامله في المحلول ، وبالتالي ، فالتركيز الجزيئي لأيونات الهيدروكسيل مساو تماما للتركيز الجزيئي لهيدروكسيد البوتاسيوم. وينطبق هذا الافتراض على محاليل الاحماض او الاسس القوية المخففة نسبيا ولا ينطبق على محاليل الاحماض او الأسس الضعيفة . وبما ان هذه الكهارل الضعيفة تتأين بشكل خفيف في المحاليل، فإنه يتوجب علينا حساب تركيز ايونات الهيدروجين أو (الهيدروكسيل) الناتجة عن مولية (معينة للحمض او الأساس) باستخدام ثابتة التفارق او التأين قبل حساب [H+] أو [OH-] الاجمالي، ومن ثم حساب قيمة الباهاء (pH).
 الاكثر قراءة في مواضيع عامة في الكيمياء الحياتية
الاكثر قراءة في مواضيع عامة في الكيمياء الحياتية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


