
Primary and secondary cells
 المؤلف:
Stan Gibilisco
المؤلف:
Stan Gibilisco
 المصدر:
Teach Yourself Electricity and Electronics
المصدر:
Teach Yourself Electricity and Electronics
 الجزء والصفحة:
119
الجزء والصفحة:
119
 17-4-2021
17-4-2021
 2415
2415
Primary and secondary cells
Some electrical cells, once their potential (chemical) energy has all been changed to electricity and used up, must be thrown away. They are no good anymore. These are called primary cells. Other kinds of cells, like the lead-and-acid unit depicted above, can get their chemical energy back again. Such a cell is a secondary cell.
Primary cells include the ones you usually put in a flashlight, in a transistor radio, and in various other consumer devices. They use dry electrolyte pastes along with metal electrodes. They go by names such as dry cell, zinc-carbon cell, alkaline cell, and others. Go into a department store and find the panel of batteries, and you’ll see various sizes and types of primary cells, such as AAA batteries, D batteries, camera batteries, and watch batteries. You should know by now that these things are cells, not true batteries. This is a good example of a misnomer that has gotten so widespread that store clerks might look at you funny if you ask for a couple of cells. You’ll also see real batteries, such as the little 9-V transistor batteries and the large 6-V lantern batteries.
Secondary cells can also be found increasingly in consumer stores. Nickel-cadmium (Ni-Cd or NICAD) cells are probably the most common. They’re available in some of the same sizes as nonrechargeable dry cells. The most common sizes are AA, C, and D. These cost several times as much as ordinary dry cells, and a charging unit also costs a few dollars. But if you take care of them, these rechargeable cells can be used hundreds of times and will pay for themselves several times over if you use a lot of “batteries” in your everyday life.
The battery in your car is made from secondary cells connected in series. These cells recharge from the alternator or from an outside charging unit. This battery has cells like the one in Fig. 1. It is extremely dangerous to short-circuit the terminals of such a battery, because the acid (sulfuric acid) can “boil” out and burn your skin and eyes.
An important note is worth making here: Never short-circuit any cell or battery, because it might burst or explode.
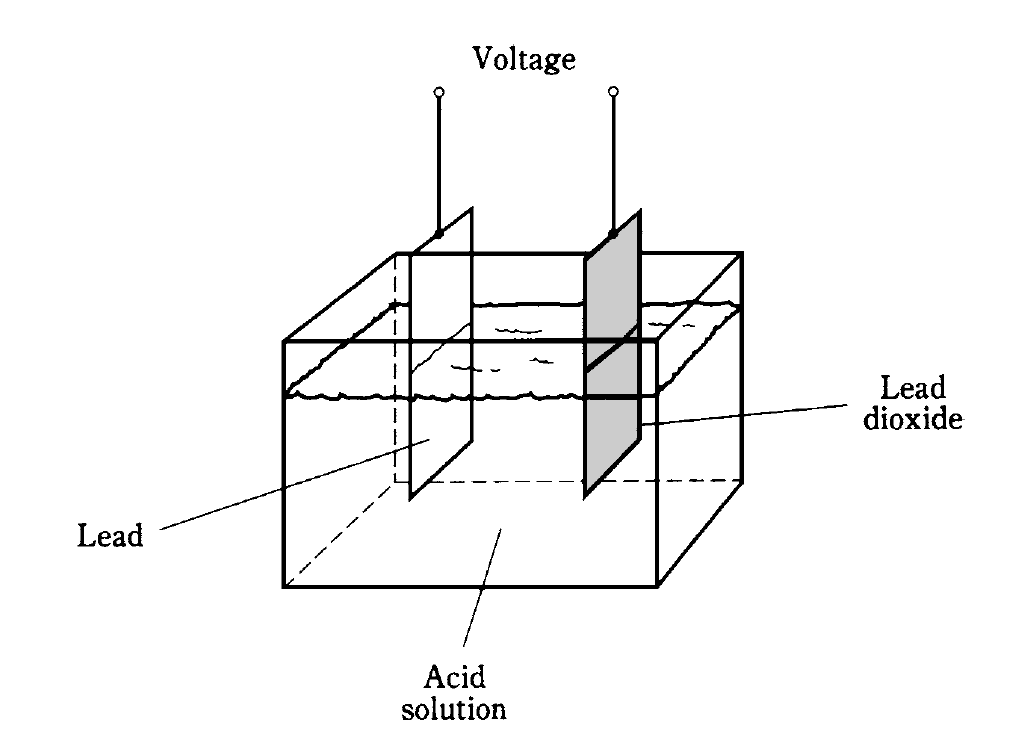
Fig. 1: Construction of a lead-acid electrochemical cell.
 الاكثر قراءة في الألكترونيات
الاكثر قراءة في الألكترونيات
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


