علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
Base Pairing
المؤلف:
William Reusch
المصدر:
Virtual Textbook of Organic Chemistry
الجزء والصفحة:
............
24-8-2018
2451
Base Pairing
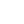
Careful examination of the purine and pyrimidine base components of the nucleotides reveals that three of them could exist as hydroxy pyrimidine or purine tautomers, having an aromatic heterocyclic ring. Despite the added stabilization of an aromatic ring, these compounds prefer to adopt amide-like structures. These options are shown in the following diagram, with the more stable tautomer drawn in blue.
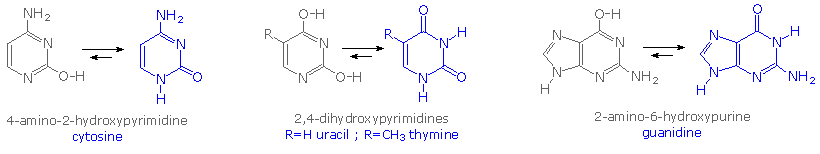
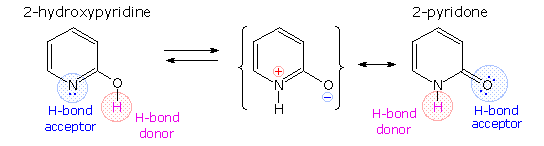
A simple model for this tautomerism is provided by 2-hydroxypyridine. As shown on the left below, a compound having this structure might be expected to have phenol-like characteristics, such as an acidic hydroxyl group. However, the boiling point of the actual substance is 100º C greater than phenol and its acidity is 100 times less than expected (pKa = 11.7). These differences agree with the 2-pyridone tautomer, the stable form of the zwitterionic internal salt.
Note that this tautomerism reverses the hydrogen bonding behavior of the nitrogen and oxygen functions (the N-H group of the pyridone becomes a hydrogen bond donor and the carbonyl oxygen an acceptor).
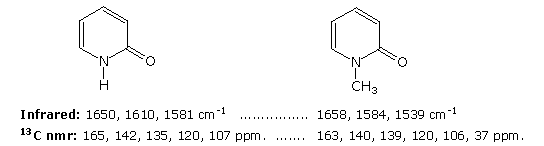
The additional evidence for the pyridone tautomer, that appears above by clicking on the diagram, consists of infrared and carbon nmr absorptions associated with and characteristic of the amide group. The data for 2-pyridone is given on the left. Similar data for the N-methyl derivative, which cannot tautomerize to a pyridine derivative, is presented on the right.
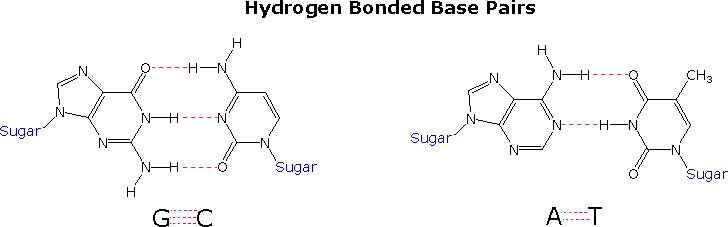
Once they had identified the favored base tautomers in the nucleosides, Watson and Crick were able to propose a complementary pairing, via hydrogen bonding, of guanosine (G) with cytidine (C) and adenosine (A) with thymidine (T). This pairing, which is shown in the following diagram, explained Chargaff's findings beautifully, and led them to suggest a double helix structure for DNA.
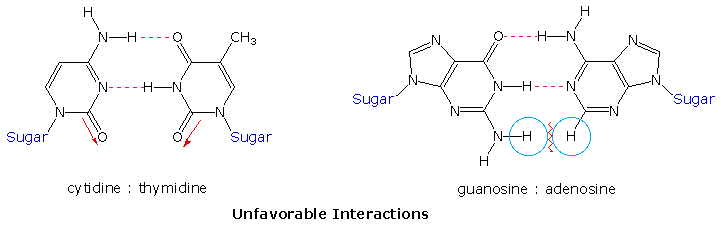
Before viewing this double helix structure itself, it is instructive to examine the base pairing interactions in greater detail. The G#C association involves three hydrogen bonds (colored pink), and is therefore stronger than the two-hydrogen bond association of A#T. These base pairings might appear to be arbitrary, but other possibilities suffer destabilizing steric or electronic interactions. . The C#T pairing on the left suffers from carbonyl dipole repulsion, as well as steric crowding of the oxygens. The G#A pairing on the right is also destabilized by steric crowding (circled hydrogens).
A simple mnemonic device for remembering which bases are paired comes from the line construction of the capital letters used to identify the bases. A and T are made up of intersecting straight lines. In contrast, C and G are largely composed of curved lines. The RNA base uracil corresponds to thymine, since U follows T in the alphabet.
 الاكثر قراءة في الاحماض النووية
الاكثر قراءة في الاحماض النووية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)