
تاريخ الفيزياء

علماء الفيزياء


الفيزياء الكلاسيكية

الميكانيك

الديناميكا الحرارية


الكهربائية والمغناطيسية

الكهربائية

المغناطيسية

الكهرومغناطيسية


علم البصريات

تاريخ علم البصريات

الضوء

مواضيع عامة في علم البصريات

الصوت


الفيزياء الحديثة


النظرية النسبية

النظرية النسبية الخاصة

النظرية النسبية العامة

مواضيع عامة في النظرية النسبية

ميكانيكا الكم

الفيزياء الذرية

الفيزياء الجزيئية


الفيزياء النووية

مواضيع عامة في الفيزياء النووية

النشاط الاشعاعي


فيزياء الحالة الصلبة

الموصلات

أشباه الموصلات

العوازل

مواضيع عامة في الفيزياء الصلبة

فيزياء الجوامد


الليزر

أنواع الليزر

بعض تطبيقات الليزر

مواضيع عامة في الليزر


علم الفلك

تاريخ وعلماء علم الفلك

الثقوب السوداء


المجموعة الشمسية

الشمس

كوكب عطارد

كوكب الزهرة

كوكب الأرض

كوكب المريخ

كوكب المشتري

كوكب زحل

كوكب أورانوس

كوكب نبتون

كوكب بلوتو

القمر

كواكب ومواضيع اخرى

مواضيع عامة في علم الفلك

النجوم

البلازما

الألكترونيات

خواص المادة


الطاقة البديلة

الطاقة الشمسية

مواضيع عامة في الطاقة البديلة

المد والجزر

فيزياء الجسيمات


الفيزياء والعلوم الأخرى

الفيزياء الكيميائية

الفيزياء الرياضية

الفيزياء الحيوية

الفيزياء العامة


مواضيع عامة في الفيزياء

تجارب فيزيائية

مصطلحات وتعاريف فيزيائية

وحدات القياس الفيزيائية

طرائف الفيزياء

مواضيع اخرى
أشعة إكس (السينية) واطياف الذرات عديدة الإلكترونات
المؤلف:
فريدريك بوش ، دافيد جيرد
المصدر:
اساسيات الفيزياء
الجزء والصفحة:
ص 1058
10-7-2016
4064
أشعة إكس (السينية) واطياف الذرات عديدة الإلكترونات
يدلنا مبدأ بأولى للاستبعاد على كيفية تعبئة الإلكترونات داخل ذرة ما في حالتها الأرضية. وعلى ذلك تكون طاقة إلكترون في ذرة عديدة الإلكترونات هي في طاقة إلكترون موجود في نفس الحالة في ذرة الهيدروجين مضروبة في Z2. وينهار هذا التقريب بالنسبة للإلكترونات الخارجية للذرة ــ مع ذلك ــ لأن طاقات التفاعل بين هذه الإلكترونات تقترب من فروق الطاقة بين مستويات طاقة بوهر. وهكذا لا تستطيع طاقات بوهر أن تنطبق على هذه الإلكترونات الخارجية.
على أن، طاقة التفاعل بين الإلكترونات تكون صغيرة بالنسبة لفروق الطاقة بين الحالتين n =1 و n =2. ففي حالة الزنك، مثلاً، (Z = 30)، تكون طاقات بوهر هي:
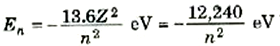
ويصبح الموقف اكثر إبهاراً بالنسبة للذهب (Z = 79) حيث،
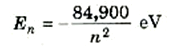
فكما نرى ، تصبح فروق الطاقة بين الحالتين E1 وE2 في هذه الذرات مقدرة بعشرات الآلاف من الإلكترون فولت، وإذا قورنت طاقات التفاعل الكولومية بين الإلكترونات بطاقات ما بين القشرات هذه، فإنها ستبدو صغيرة. ومن ثم تكون طاقات بوهر صحيحة تقريباً بالنسبة للإلكترونات الموجودة في القشرتين n =1 و n =2 للذرات ذات الأعداد الذرية الكبيرة.
فإذا انتقلنا إلى إلكترون موجود في قشرة خارجية فإن الموقف سيبدو مختلفاً تماماً. أولاً، ستظهر إلكتروناً القشرات الداخلية وهي تلغى جزء من الشحنة النووية وذلك لكونها أقرب إلى النواة، ولذلك فإن الكترونات القشرة n =2 "ترى" الشحنة النووية وكأنها (Z – 2)e تقريباً بدلاً Ze؛ وبالمثل فإن إلكتروناً الموجودين في القشرة n =1 والإلكترونات الثمانية الموجود في القشرة n =2. ويقال عندئذ أن الإلكترونات الداخلية " تحجب" الشحنة النووية عن الإلكترونات الخارجية.
وعلاوة على هذا التأثير فإن الإلكترونات القشرة الخارجية معرضة لطاقات من ناحية التفاعل التنافري للإلكترونات مع بعضها البعض والذي يكتنف كل الإلكترونات الاخرى بالذرة. ولقد ذكرنا من قبل أن هذه الطاقات تقترب في مقاديرها مع الفروق الصغيرة في الطاقة بين القشرات الخارجية، وأن معادلة بوهر للطاقة لا تنطبق عليهم.
إن الذرة لكي تشع، فلابد لبعض إلكتروناتها من أن تستثار إلى طاقات أعلى، وحيث أن إلكتروناً المدارات الخارجية لا تحتاج سوى لقدر ضئيل من الطاقة حتى تستثار إلى حالات فارغة، لذا لن يكون من الصعب الحصول على ضوء مرئي من ذرات ذات Z مرتفعة. وما يحدث ببساطة هو أن تبخر المادة وتستخدم داخل أنبوبة تفريع. إلا أن خطوط الطيف التي تنبعث نتيجة انتقالات بين مستويات القشرة الخارجية تلك عديدة ومعقدة جداً.
يصبح الموقف مختلفاً تماماً بالنسبة للانتقالات التي تتضمن إلكتروناً القشرة الداخلية. أن القشرات n =1 ، n =2، n =3 تكون ممتلئة في حالة ذرة الزنك غير المستثارة، ومن ثم لا يمكن استثارة إلكترون داخلي (n =1) إلى أي من القشرتين n =2 أو n =3 الممتلئتين بسبب مبدأ الاستبعاد. ولكي نستثير إلكتروناً من n =1، فإن الطاقة التي لابد من إمداد الذرة بها، يجب أن تكون ـ على الأقل ــ كافية للسماح للإلكترون بالقفز إلى القشرة n =4. . وهذه الطاقة تصل إلى نحو 12,000 eV في حالة الزنك. وبمجرد حدوث تلك القفزة، فإن ثغرة تنشأ في القشرة n =1، وعندئذ يستطيع إلكترون من إحدى القشرتين n =2 أو n =3، أن يقفز بسهولة نحو تلك الثغرة، مطلقاً فوتوناً ذا طاقة مساوية لفرق الطاقة بين الحالتين النهائية والابتدائية للإلكترون. غذا ما هبط إلكترون من n =2 إلى n =1فإن طاقة الفوتون الذي سيطلقه ستصل إلى نحو 9000 eV. أن الفوتون الذي طاقته 1 eV يكون طوله الموجي 1240 nm ، لذا فالطاقة 9000 eV ستناظر طولاً موجياً مقداره:
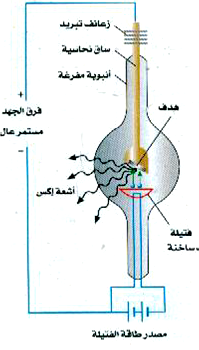
الشكل 1)): تقذف الإلكترونات المنبعثة من الفتيل الساخن سطح الهدف الذي يقوم بإطلاق أشعة إكس.

ويقع هذا الطول الموجي في منطقة أشعة إكس. هكذا نكتشف أن الانتقالات بين القشرات الداخلية في ذرة ذات Z مرتفعة، تؤدي إلى ظهور أشعة إكس ولكي نولد أشعة إكس يلزمنا أن نستشير إلكترونات القشرة الداخلية نحو قشرات خارجية خالية، ويستلزم هذا ــ كما رأينا ــ كميات ضخمة من الطاقة.
يوضح الشكل 1)) دائرة أنبوبة إكس نموذجية، حيث تنبعث الإلكترونات من فتيلة ساخنة ثم تعجل عبر فرق للجهد من المرتبة 105V. وعندما ترتطم هذه الإلكترونات ذات الطاقة المرتفعة بالذرات ذات العدد الذري Z الكبير في الهدف فإنها تقتلع إلكترونات من القشرات الداخلية للذرات. وعندما تهبط إلكترونات اخرى نحو الثغرات المتكونة، فإن فوتونات اشعة إكس تنبعث. ويكون لأشعة إكس المنبعثة بهذه الطريقة أطوال موجية تميز فرق الطاقة بين القشرات المختلفة في الذرة؛ بمعنى أن الفوتونات المنبعثة تحمل من الطاقة ما يساوي الفرق بين طاقتي قشرتين تمثلان نقطتي النهاية والبداية بالنسبة للإلكترون الذي يهبط إلى الثغرة. ويشار إلى أشعة إكس المنبعثة في هذه العملية بأشعة إكس المميزة.

الشكل 2)): طيف أشعة إكس المنبعثة من هدف من المولبيدنم المقذوف بإلكترونات طاقتها 35,000 eV.
وهناك نوع آخر من أشعة إكس المنبعثة من الهدف المقذوف بالإلكترونات ويشار إليه بمصطلح أشعة الفرملة. وكما يقتضي معنى المصطلح، فإن هذه الأشعة تنبعث بواسطة الإلكترونات المقذوفة عندما يحدث لها إبطاء عند اصطدامها بالهدف وكلنا يعلم أن أي شحنة معجلة تقوم بإشعاع موجات كهرومغناطيسية، ولذلك يصدر إشعاع من هذه الإلكترونات المقذوفة عندما تتعرض لإبطاء قوي بواسطة الهدف. وحيث أن معدل الإبطار كبير جداً، لذا يكون الإشعاع المنبعث ذا طول موجي قصير، ويكون إشعاع الفرملة في منطقة أشعة إكس. إلا أن لأشعة الفرملة ــ خلافاً لأشعة إكس المميزة ــ مدى متصل من الأطوال الموجية وهذا يعكس حقيقة أن الإبطاء يتم بعدد لا نهائي تقريباً من الطرق المختلفة ولذلك تتباين الطاقة المنطلقة من تصدم لآخر.
يحتوي الشكل 2))على رسم بياني للإشعاع المنبعث من هدف صنع من عنصر الموليبدنم، قذف بإلكترونات طاقتها 35,000 ev. القمتان الحادثتان بالشكل هما أشعة إكس المميزة المنبعثة نتيجة هبوط الإلكترونات إلى القشرة n =1 من القشرتين n =2 و n =3. وبطبيعة الحال، ينتمي الطول الموجي الأقصر للانتقال ذي الطاقة الاكبر وهو الانتقال من n =3 إلى n =1. وأشعة الفرملة هي المسئولة عن الإشعاع منخفض الشد، الذي ينتشر على مدى جميع الاطوال الموجية الأكبر من mλ. وحيث أن طاقة الإلكترونات المقذوفة كانت 35,000 eV، فإن الفوتونات المنبعثة لا يمكن أن تتخذ طاقات أكبر من هذه القيمة، فإذا استخدمنا التحويل الذي يقتضي أن الطول الموجي 1240 nm يكافئ 1 eV لوجدنا أن 35,000 eV تناظر 1240/35,000 = 0.035. وكما هو واضح من الشكل (2) فإن أكبر طاقة لأشعة الفرملة هي بالفعل، ما يناظر هذا الطول الموجي.
 الاكثر قراءة في الفيزياء الذرية
الاكثر قراءة في الفيزياء الذرية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















