
Arsenides, antimonides and bismuthides
 المؤلف:
CATHERINE E. HOUSECROFT AND ALAN G. SHARPE
المؤلف:
CATHERINE E. HOUSECROFT AND ALAN G. SHARPE
 المصدر:
Inorganic Chemistry
المصدر:
Inorganic Chemistry
 الجزء والصفحة:
p 403
الجزء والصفحة:
p 403
 19-2-2018
19-2-2018
 2446
2446
Arsenides, antimonides and bismuthides
Metal arsenides, antimonides and bismuthides can be prepared by direct combination of the metal and group 15 element. Like the phosphides, classification is not simple, and structure types vary. Our coverage here is, therefore, selective Gallium arsenide is an important semiconductor and crystallizes with a zinc blende lattice.
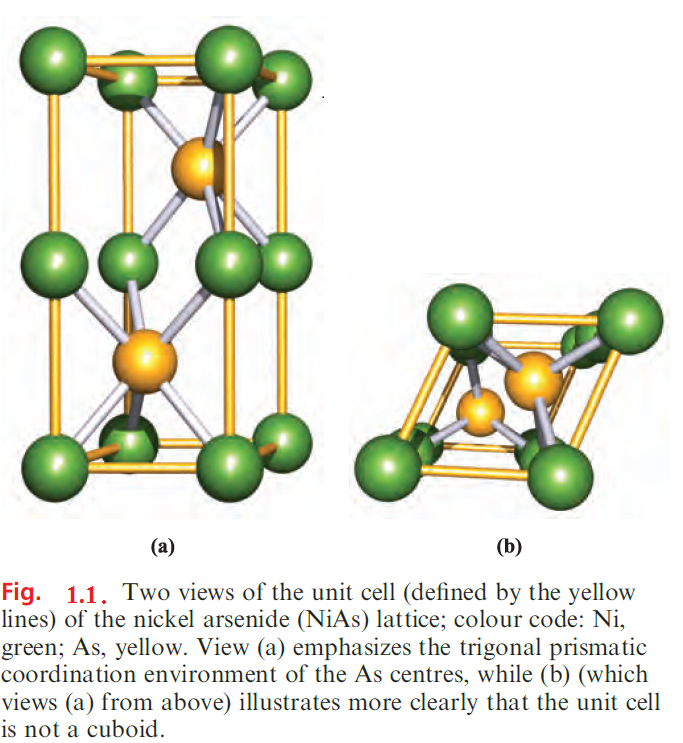
Slow hydrolysis occurs in moist air and protection of semiconductor devices from the air is essential; N2 is often used as a ‘blanket gas’. Nickel arsenide, NiAs, gives its name to a well-known structure type, being adopted by a number of d-block metal arsenides, antimonides, sulfides, selenides and tellurides.
The lattice can be described as a hexagonal close-packed (hcp) array of As atoms with Ni atoms occupying octahedral holes. Although such a description might conjure up the concept of an ionic lattice, the bonding in NiAs is certainly not purely ionic. Figure 1.1 shows a unit cell of NiAs. The placement of the Ni atoms in octahedral holes in the hcp arrangement of As atoms means that the coordination environment of the As centres is trigonal prismatic. Although each Ni atom has six As neighbours at 243 pm, there are two Ni neighbours at a distance of only 252pm (compare rmetal(Ni)=125 pm) and there is almost certainly Ni_Ni bonding running through the structure. This is consistent with the observation that NiAs conducts electricity.
Arsenides and antimonides containing the [As7]3- and [Sb7]3- ions can be prepared by, for example, reactions below. These Zintl ions are structurally related to [P7]3- .
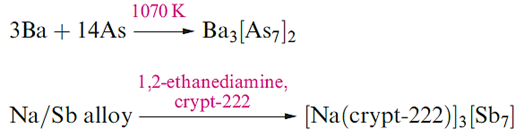
Heteroatomic Zintl ions incorporating group 15 elements are present in the compounds [K(crypt 222)]2[Pb2Sb2], [K(crypt-222)]2[GaBi3], [K(crypt-222)]2[InBi3] and [Na(crypt-222)]3[In4Bi5], all of which are prepared (mostly as solvates with 1,2-ethanediamine) in a similar way to reaction above. The [Pb2Sb2]2-, [GaBi3]2- and [InBi3]2- ions are tetrahedral in shape. The [In4Bi5]3- ion adopts a monocapped square-antiprism in which the Bi atoms occupy the unique capping site and the four open-face sites. These structures are consistent with Wade’s rules.
 الاكثر قراءة في مواضيع عامة في الكيمياء اللاعضوية
الاكثر قراءة في مواضيع عامة في الكيمياء اللاعضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


