
Oxoacids of selenium and tellurium
 المؤلف:
CATHERINE E. HOUSECROFT AND ALAN G. SHARPE
المؤلف:
CATHERINE E. HOUSECROFT AND ALAN G. SHARPE
 المصدر:
INORGANIC CHEMISTRY
المصدر:
INORGANIC CHEMISTRY
 الجزء والصفحة:
2th ed p 462
الجزء والصفحة:
2th ed p 462
 22-3-2017
22-3-2017
 2155
2155
Oxoacids of selenium and tellurium
Selenous acid, H2SeO3, may be crystallized from aqueous solutions of SeO2 and gives rise to two series of salts containing the [HSeO3]- and [SeO3] 2- ions. In aqueous solution, it behaves as a weak acid: pKa(1) ≈ 2.46, pKa(2( ≈ 7:31. Heating salts of [HSeO3]- generates diselenites containing ion 1.1. Tellurous acid, H2TeO3, is not as stable as H2SeO3 and is usually prepared in aqueous solution where it acts as a weak acid: pKa(1) ≈ 2.48, pKa(2) ≈ 7.70. Most tellurite salts contain the [TeO3] 2- ion.
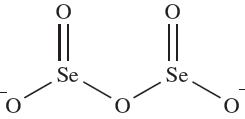

(1.1)
Oxidation of H2SeO3 with 30% aqueous H2O2 yields selenic acid, H2SeO4, which may be crystallized from the solution. In some ways it resembles H2SO4, being fully dissociated in aqueous solution with respect to loss of the first proton. For the second step, pKa =1.92. It is a more powerful oxidant than H2SO4, e.g. it liberates Cl2 from concentrated HCl. Reaction in the solid state between Na2SeO4 and Na2O (2 :1 molar equivalents) leads to Na6Se2O9. This formula is more usefully written as Na12(SeO6)(SeO4)3, showing the presence of the octahedral [SeO6]6- ion which is stabilized in the crystalline lattice by interaction with eight Na ions. The [SeO5]4- ion has been established in Li4SeO5 and Na4SeO5. The formula, H6TeO6 or Te(OH)6, and properties of telluric acid contrast with those of selenic acid. In the solid, octahedral molecules (1.2) are present and in solution, it behaves as a weak acid: pKa)1( = 7.68, pKa)2( = 11.29. Typical salts include those containing [Te)O((OH)5]- and [Te(O)2(OH)4]2- and the presence of the [TeO4]2- ion has been confirmed in the solid state structure of Rb6[TeO5][TeO4].

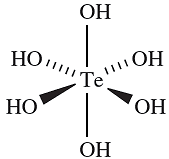
(1.2)
 الاكثر قراءة في مواضيع عامة في الكيمياء اللاعضوية
الاكثر قراءة في مواضيع عامة في الكيمياء اللاعضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


