
Colour of d-block metal compounds
 المؤلف:
CATHERINE E. HOUSECROFT AND ALAN G. SHARPE
المؤلف:
CATHERINE E. HOUSECROFT AND ALAN G. SHARPE
 المصدر:
INORGANIC CHEMISTRY
المصدر:
INORGANIC CHEMISTRY
 الجزء والصفحة:
2th ed p 538
الجزء والصفحة:
2th ed p 538
 23-2-2017
23-2-2017
 1098
1098
Colour
The colours of d-block metal compounds are a characteristic feature of species with ground state electronic configurations other than d0 and d10. For example, [Cr(H2O)6]2+ is skyblue, [Mn(H2O)6]2+ very pale pink, [Co)H2O(6]2+ pink, [MnO4]- intense purple and [CoCl4]2- dark blue. In contrast, salts of Sc(III) (d0) or Zn(II) (d10) are colourless.
The fact that many of the observed colours are of low intensity is consistent with the colour originating from electronic ‘d–d’ transitions. If we were dealing with an isolated gas-phase ion, such transitions would be forbidden by the Laporte selection rule (equation 1.1 where l is the orbital quantum number). The pale colours indicate that the probability of a transition occurring is low. Table 1.1shows relationships between the wavelength of light absorbed and observed colours.
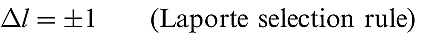 (1.1)
(1.1)
Table 1.1 The visible part of the electromagnetic spectrum.
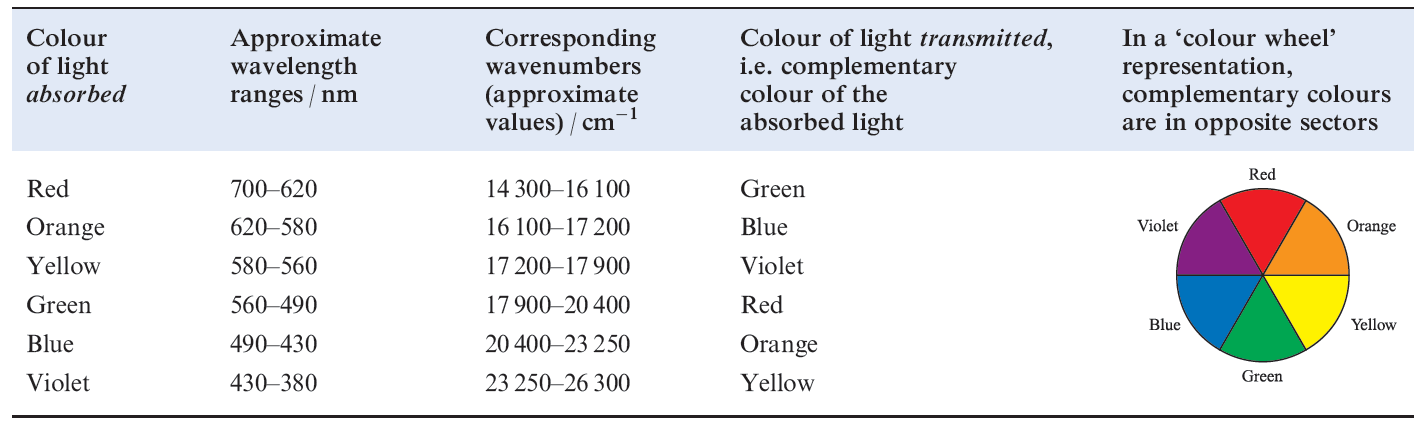
The intense colours of species such as [MnO4]- have a different origin, namely charge transfer absorptions or emissions . The latter are not subject to selection rule 1.1 and are always more intense than electronic transitions between different d orbitals.
 الاكثر قراءة في كيمياء العناصر الانتقالية ومركباتها المعقدة
الاكثر قراءة في كيمياء العناصر الانتقالية ومركباتها المعقدة
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


